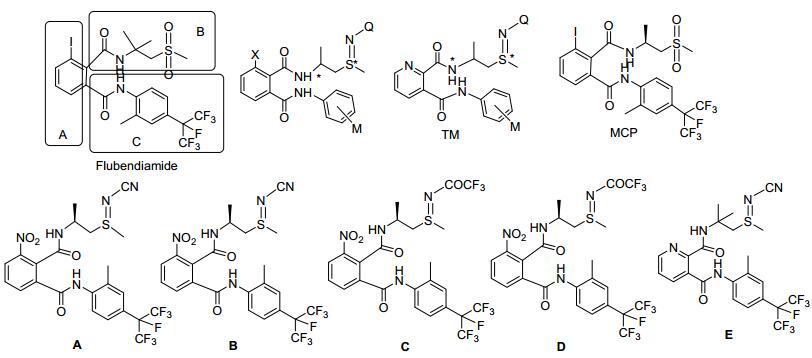
 图 1
氟虫酰胺和目标化合物的结构
Figure 1.
Chemical structures of flubendiamide and title compounds
图 1
氟虫酰胺和目标化合物的结构
Figure 1.
Chemical structures of flubendiamide and title compounds

Citation: Meng Xiangde, Zhou Sha, Xie Yongtao, Zhao Yu, Xiong Lixia, Zhou Sha, Li Zhengming. Design, Synthesis and Biological Activities of Novel Dual-Chiral Carbon and Sulfur Pyridine Phthalic Acid Diamide Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 908-913. doi: 10.6023/cjoc201610027

新型碳硫双手性含吡啶结构的邻苯二甲酰胺类化合物的设计、合成与生物活性研究
English
Design, Synthesis and Biological Activities of Novel Dual-Chiral Carbon and Sulfur Pyridine Phthalic Acid Diamide Derivatives
-
Key words:
- pyridine
- / phthalic acid diamides
- / synthesis
- / insecticidal activity
- / dual-chiral
-
近几年来, 随着昆虫对各种杀虫剂的抗药性不断增强, 研发新型、环境友好杀虫剂逐渐成为众多科研人员的目标.鱼尼丁受体作为新型靶标类杀虫剂, 具有结构新颖、作用机制独特、高效活性以及对哺乳动物安全等特点, 自走向市场后得到很快的发展. 1998年[1~3], 日本农药公司研发鱼尼丁受体杀虫剂-氟虫酰胺 (Flubendiamide), 到2001年, 杜邦公司研发出氯虫酰胺 (Chlorantraniliprole), 随后根据电子生物等排效应的设计理念推出内吸性好的产品氰虫酰胺 (Cyantraniliprole).其作用机理是激活钙离子通道-鱼尼丁受体, 引起钙离子流失, 进而导致昆虫死亡.
当今市面上销售的农药中具有手性中心的占25%以上[4], 这类农药通常被称为手性农药, 手性中心一般为碳、磷或氮原子等.目前, 在商品化的650余种农药中, 手性农药达170余种, 不仅含有单一纯手性异构体的商品, 还含有高活性手性体的农药品种.其中具有高活性手性结构的手性农药销售额超过100亿美元, 纯手性异构体的手性农药年销售额已接近30亿美元, 手性农药销售额已占全球农药市场的35%, 而且这种比例仍然在不断增加.由于生物体对立体选择性能力的差异, 以及不同靶标对不同手性异构体的匹配性关系具有一定差异, 因此手性对映体往往表现出不同的生物活性, 也致使有些手性体表现出高的杀虫、杀螨、杀菌和除草活性, 而其对映体生物活性完全相反或者较差.单一高活性手性体或不含无效手性体的手性农药表现出低剂量高药效的突出特点, 减少了自然界农药的使用量, 提高了经济效益, 因此, 手性农药成为近20年来增长较快的农药品系之一.由于农药表现出强烈的立体识别作用, 研究手性在农药分子结构中的作用也变得十分重要, 而双手性的引入在新型鱼尼丁受体杀虫剂的研究中还不常见.
我们课题组在鱼尼丁受体杀虫剂前期的工作研究中, 设计合成双手性含有硫亚胺和亚磺酰亚胺结构的双酰胺类化合物, 此类结构具有优异的杀虫活性[5, 6], 其中部分化合物对东方粘虫的生物活性与氟虫酰胺相当或者略高, 对小菜蛾的生物活性部分结构优于商品化品种氟虫酰胺; 设计合成含硫亚胺和亚磺酰亚胺的邻苯二甲酰胺类化合物, 发现大部分化合物具体优异的杀虫活性[7].由以上鱼尼丁受体杀虫剂研究开发所带来新的思路, 在此工作基础上, 我们根据电子生物等排体效应, 引入吡啶环代替硝基取代的苯环, 设计合成双手性含吡啶结构的邻苯二甲酰胺类化合物, 探索吡啶环对碳硫双手性双酰胺类结构的生物活性的影响. 图 1为目标化合物结构设计以及对照化合物A~E[5, 6].
1 结果与讨论
1.1 化学反应
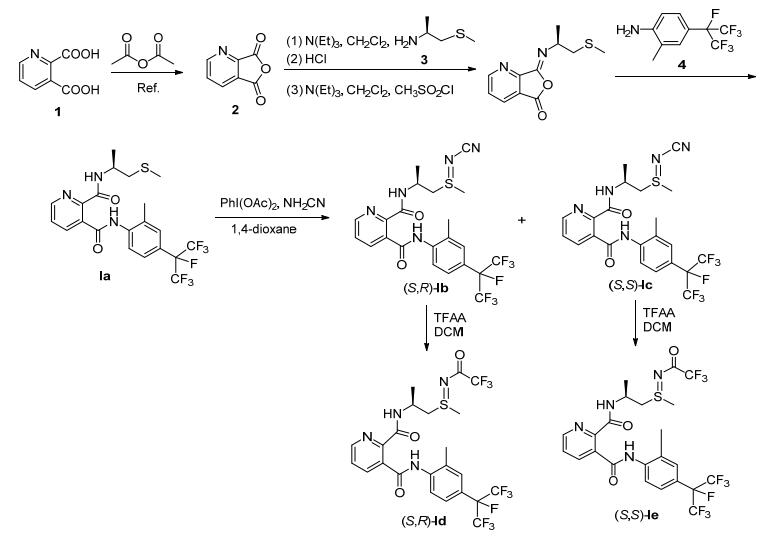
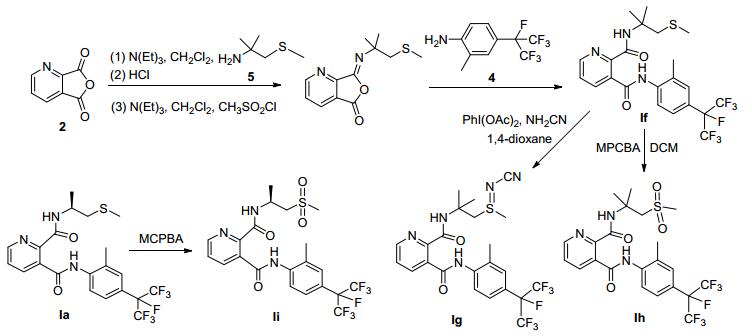
目标化合物的合成路线如Scheme 1.由喹啉酸生成喹啉酸酐, 在乙酸酐中加热回流时间比酞酐类的合成需要时间长, 可能是吡啶环的拉电子效应, 降低了反应物的反应活性.反应中溶剂二氯甲烷干燥, 可以提高反应的产率.同时, 基于前期对硫亚胺和亚磺酰类结构的探索[7~9], 设计合成双甲基取代的含吡啶双酰胺类衍生物If~Ih作为对比, 同时设计合成单甲基取代的含吡啶双酰胺类衍生物Ii作为对比 (Scheme 2).
1.2 数据分析
在此系列大部分化合物中, 芳香酰胺和脂肪酰胺的活泼H分别分布在δ 9.90~9.96和8.72~9.20.手性化合物中, 手性碳中的H呈现的m峰或者dt峰, 与手性相连的亚甲基上H由于受到手性化学环境的影响, 通常呈现两个dd峰, 与手性碳相连的甲基则呈现典型的d峰.从碳谱数据来看, 氟原子对碳的偶合效应比较突出, 七氟异丙基中两个CF3的对称性, 通常呈现一组碳的峰, 且氟原子对碳的偶合现象呈现四重峰; 七氟异丙基中CF季碳, 邻位多个F原子的偶合呈现多重峰, 且峰位较低; 与七氟异丙基相邻的苯环上的碳由于氟原子偶合呈现双重峰; 对于NCOCF3的化合物, 如Id, Ie, 与CF3相连的羰基由于受到相邻碳原子F的影响, 出现多重峰, 且峰高较低.如Id结构, 共23个碳, 由于CF3部分对称, 只出现22组碳峰, 由于氟原子的存在, 可见明显的氟碳偶合的现象, δ 115.47处为三氟乙酰基CF3峰, 由于氟原子的偶合出现四重峰; δ 119.98处为七氟异丙基CF的峰, 由于邻位多个氟原子的偶合而出现多重峰, 且峰高较低; δ 123.12处为七氟异丙基CF3峰, 由于结构对称而且受到邻位氟原子的偶合而只出现一个双峰; δ 127.01处为与七氟异丙基相连苯环碳的峰, 由于邻位氟原子的偶合而出现双峰; δ 164.57处为与CF3相连的羰基碳的碳峰, 由于邻位多个氟原子的耦合而出现多重峰, 且峰高较低.
1.3 生物活性
目标化合物对东方粘虫的杀虫活性见表 1, 从表中可以看出, 大部分化合物对东方粘虫表现中等的杀虫活性, 化合物Id和If在10 mg•L-1表现20%的杀虫活性.双手性的化合物结构中, NCN系列中, Ic (Sc, Ss)>Ib (Sc, Rs); NCOCF3系列中, Id (Sc, Rs)>Ie (Sc, Ss); 比较NCN与NCOCF3的化合物, 我们发现Id>Ib, Ie≈Ic, NCOCF3硫亚胺化合物的活性优于NCN的硫亚胺类化合物, 这与我们前期的研究结果[6~8]也是相一致的.根据电子生物等排效应, 吡啶环与含有硝基取代的苯环电子效应相似, 与苯环上含硝基取代的手性NCN和NCOCF3硫亚胺类化合物[6~8]相比, 生物活性大大降低.与商品化的氟虫酰胺和MCP相比, 化合物Ih, Ii对东方粘虫的活性大大降低; 再者, 从表 1中对比部分化合物的生物活性, E>>Ig, A, B>>Ib, Ic, C, D>>Ic, Id, 由此表明吡啶环的引入是不利于生物活性的保持和提高.在引入的吡啶环的结构化合物生物活性对比中, Ic>Ig>Ib, Ih>Ii, 可以发现脂肪酰胺部分单甲基和双甲基取代的活性相差不大, 单甲基的引入, 虽然化合物的结构分子量减小, 但是生物活性并没有明显的提高.
 表 1
目标化合物对东方粘虫的杀虫活性 (%)
Table 1.
Larvicidal activity (%) against oriental armyworm of title compounds
表 1
目标化合物对东方粘虫的杀虫活性 (%)
Table 1.
Larvicidal activity (%) against oriental armyworm of title compounds
Compd. c/(mg•L-1) 100 50 25 10 5 2.5 1 Ia 100 60 Ib 40 Ic 100 100 60 Id 100 100 100 20 Ie 100 100 40 If 100 100 100 20 Ig 100 50 Ih 100 100 100 20 Ii 100 100 60 A 100 100 100 100 100 100 40 B 100 100 100 100 100 100 100 C 100 100 100 100 60 D 100 100 100 100 100 100 100 E 100 100 100 100 100 100 100 Flubendiamide 100 100 100 100 100 表 1 目标化合物对东方粘虫的杀虫活性 (%)
Table 1. Larvicidal activity (%) against oriental armyworm of title compounds2 结论
本文设计合成了新型碳硫双手性含吡啶结构的邻苯二甲酰胺类化合物, 并对其结构进行了核磁、高分辨质谱以及比旋光度数据表征, 同时对目标化合物进行了生物活性测试.初步的生测结果表明大部分化合物表现中等的杀虫活性, Id和If在10 mg•L-1对粘虫表现20%的杀虫活性, 由此可见含有吡啶结构的邻苯二甲酰胺类不利于活性的保持和提高.
3 实验部分
3.1 仪器与试剂
L-氨基丙醇、醋酸碘代苯、氰胺、1, 4-二氧六环、氯磺酸、无水乙醇、乙醚、石油醚、乙酸乙酯等均为市售分析纯试剂, 溶剂经过干燥、提纯处理后使用, H型柱层析使用青岛海洋化工厂硅胶.
德国Bruker AVANCE 400型核磁共振波谱仪 (TMS为内标, DMSO-d6为溶剂); 美国ThermoFinnigan LCQ Advantage型质谱仪 (ESI); X-4型数字显示显微熔点仪 (北京泰克仪器有限公司).
3.2 合成
3.3 生测方法
供试昆虫为室内使用玉米叶饲养的东方粘虫正常群体, 供试虫源名称为Mythimna separate Walker, 采用文献[19~20]方法进行活性筛选.粘虫采用浸叶法, 用丙酮将样品配制成不同浓度的溶液, 浸渍相同数量的苗期玉米叶片, 晾干后将其放入7 cm培养皿中, 接入4龄幼虫, 重复实验2~4次.对照组使用相同量的丙酮溶液浸渍玉米叶, 晾干后饲养幼虫. 24 h后添加新鲜的玉米叶片.在第48、72 h进行观察, 并记录实验结果, 以粘虫完全死亡 (即触之不动) 为幼虫的死亡标准.
辅助材料 (Supporting Information) 所有化合物的NMR (DMSO-d6) 和HRMS谱图数据.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.2 目标化合物I的合成
化合物Ig参照文献[15~18]方法合成.将中间体If (1.0 mmol)、醋酸碘代苯 (1.0 mmol) 和氰胺 (1.0 mmol) 溶于盛有1, 4-二氧六环 (20.0 mL) 的50 mL单口圆底烧瓶中, 在冰水浴的条件下, 搅拌30 min.将温度缓慢升温至25 ℃, 继续搅拌反应, 用薄层色谱 (TLC) 检测反应进度, 反应结束后, 将混合物倒入水中, 用乙酸乙酯 (20.0 mL×3) 萃取, 然后经过一系列酸洗、碱洗和盐洗干燥等后处理, 旋蒸除去溶剂, 得粗产物, 用硅胶柱色谱层析得纯品Ig.
(S)-N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(甲硫基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ia):白色固体, 产率72.14%. m.p. 121~123 ℃; [α]D20+2.40 (c 0.5, MeOH); 1H NMR (DMSO-d6, 400 MHz) δ: 10.55 (s, 1H, Ar-NH), 8.68 (dd, J=4.6, 1.6 Hz, 1H, Ar-H), 8.45 (d, J= 7.5 Hz, 1H, Ar-H), 8.29 (d, J=7.0 Hz, 1H, Ar-H), 8.20 (d, J=7.8 Hz, 1H, Ar-H), 7.60 (dd, J=7.9, 4.6 Hz, 1H, Ar-H), 7.48 (d, J=8.4 Hz, 1H, Ar-H), 7.44 (s, 1H, CNH), 4.41~ 4.34 (m, 1H, NCH), 2.75 (qd, J=13.5, 6.0 Hz, 2H, SCH2), 2.44 (s, 3H, SCH3), 2.16 (s, 3H, ArCH3), 1.38 (d, J=6.7 Hz, 3H, CCH3); 13C NMR (DMSO-d6, 100 MHz) δ: 15.17, 17.83, 19.57, 40.20, 44.14, 120.78, 119.72, 120.98, 123.10, 125.38, 125.88, 126.99, 132.49, 133.39, 136.89, 139.57, 147.09, 148.64, 163.03, 166.76. HRMS calcd for C21H21F7-N3O2S [M+H]+ 512.1237, found 512.1239.
(S, R)-N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(N-氰基-S-甲基硫亚胺基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ib):白色固体, 产率78.21%. m.p. 109~110 ℃; [α]D20-26.8 (c 0.5, MeOH); 1H NMR (DMSO-d6, 400 MHz) δ: 9.90 (s, 1H, Ar-NH), 9.14 (d, J=8.8 Hz, 1H, CNH), 8.75 (d, J=3.3 Hz, 1H, Ar-H), 8.04 (d, J=7.3 Hz, 1H, Ar-H), 7.95 (d, J=8.3 Hz, 1H, Ar-H), 7.72 (dd, J= 7.7, 4.8 Hz, 1H, Ar-H), 7.55~7.51 (m, 2H, Ar-H), 4.42~ 4.34 (m, 1H, NCH), 3.40 (d, J=7.1 Hz, 2H, SCH2), 2.83 (s, 3H, SCH3), 2.36 (s, 3H, ArCH3), 1.33 (d, J=6.7 Hz, 3H, CCH3); 13C NMR (DMSO-d6, 100 MHz) δ: 18.39, 20.21, 32.67, 41.44, 55.82, 120.83, 121.23, 121.32, 121.53, 123.64, 125.88, 126.60, 127.50, 133.07, 133.95, 137.46, 140.06, 147.37, 149.23, 164.02, 167.11. HRMS calcd for C21H21F7N5O2S [M+H]+ 552.1299, found 552.1302.
(S, S)-N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(N-氰基-S-甲基硫亚胺基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ic):白色固体, 产率27.19%. m.p. 86~87 ℃; [α]D20+31.8 (c 0.5, MeOH). 1H NMR (DMSO-d6, 400 MHz) δ: 9.91 (s, 1H, Ar-NH), 9.06 (d, J=8.5 Hz, 1H, CNH), 8.74 (d, J=3.4 Hz, 1H, Ar-H), 8.03 (d, J=7.1 Hz, 1H, Ar-H), 7.97 (d, J=8.3 Hz, 1H, Ar-H), 7.73 (dd, J= 7.8, 4.6 Hz, 1H, Ar-H), 7.53 (d, J=13.7 Hz, 2H, Ar-H), 4.42~4.36 (m, 1H, NCH), 3.51 (dd, J=13.2, 10.3 Hz, 1H, SCH2), 3.29 (d, J=4.0 Hz, 1H, SCH2), 2.82 (s, 3H, SCH3), 2.35 (s, 3H, ArCH3), 1.31 (d, J=6.6 Hz, 3H, CCH3); 13C NMR (DMSO-d6, 100 MHz) δ: 18.12, 20.29, 32.97, 41.04, 54.49, 119.54, 121.34, 121.46, 121.96, 123.63, 126.29, 126.71, 127.55, 133.40, 133.61, 137.29, 139.45, 146.89, 149.45, 164.23, 167.66. HRMS calcd for C22H21F7N5O2S [M+H]+ 552.1299, found 552.1302.
(S, R)-N3-[2-甲基-4-(七氟异丙基-2-剂) 苯基]-N2-[1-(N-三氟乙酰基-S-甲基硫亚胺基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Id):白色固体, 产率88.79%. m.p. 179~ 187 ℃; [α]D20 -10.2 (c 0.5, MeOH); 1H NMR (DMSOd6, 400 MHz) δ: 9.96 (s, 1H, Ar-NH), 9.21 (d, J=8.6 Hz, 1H, CNH), 8.75 (d, J=3.6 Hz, 1H, Ar-H), 8.06 (d, J=7.3 Hz, 1H, Ar-H), 7.95 (d, J=8.3 Hz, 1H, Ar-H), 7.74 (t, J= 4.4 Hz, 1H, Ar-H), 7.53 (d, J=13.2 Hz, 2H, Ar-H), 4.44~ 4.41 (m, 1H, NCH), 3.66~3.57 (m, 2H, SCH2), 2.86 (s, 3H, SCH3), 2.36 (s, 3H, ArCH3), 1.33 (d, J=6.5 Hz, 3H, CCH3); 13C NMR (DMSO-d6, 100 MHz) δ: 17.85, 19.78, 28.46, 40.50, 51.90, 115.47, 119.98, 120.88, 121.08, 123.12, 125.42, 126.12, 127.01, 132.63, 133.51, 136.96, 139.54, 146.79, 148.73, 163.61, 164.57, 166.58. HRMS calcd for C23H21F10N4O3S [M + H] + 623.1169, found 623.1175.
(S, S)-N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(N-三氟乙酰基-S-甲基硫亚胺基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ie):白色固体, 产率90.32%. m.p. 85~86 ℃; [α]D20+12.8 (c 0.5, MeOH); 1H NMR (DMSO-d6, 400 MHz) δ: 9.93 (s, 1H, Ar-NH), 9.11 (d, J=8.3 Hz, 1H, CNH), 8.74 (d, J=4.4 Hz, 1H, Ar-H), 8.04 (d, J=7.4 Hz, 1H, Ar-H), 7.96 (d, J=8.1 Hz, 1H, Ar-H), 7.73 (t, J=4.0 Hz, 1H, Ar-H), 7.53 (d, J=13.4 Hz, 2H, Ar-H), 4.46~4.43 (m, 1H, NCH), 3.65~3.56 (m, 2H, SCH2), 2.85 (s, 3H, SCH3), 2.35 (s, 3H, ArCH3), 1.32 (d, J=6.3 Hz, 3H, CCH3); 13C NMR (DMSO-d6, 100 MHz) δ: 17.76, 19.96, 29.65, 41.52, 51.91, 116.00, 119.32, 122.01, 122.22, 123.34, 125.96, 126.38, 127.34, 133.28, 133.62, 137.08, 139.52, 146.83, 149.10, 164.00, 165.57, 167.55. HRMS calcd for C23H21F10N4O3S [M + H] + 623.1169, found 623.1175.
N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(甲硫基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (If):白色固体, 产率70.56%. m.p. 78~80 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 9.90 (s, 1H, Ar-NH), 8.73~8.70 (m, 1H, Ar-H), 8.22 (s, 1H, CNH), 8.03 (d, J=7.7 Hz, 1H, Ar-H), 7.96 (d, J=8.4 Hz, 1H, Ar-H), 7.71 (dd, J=7.7, 4.8 Hz, 1H, Ar-H), 7.57~ 7.51 (m, 2H, Ar-H), 2.99 (s, 2H, SCH2), 2.36 (s, 3H, SCH3), 2.09 (s, 3H, ArCH3), 1.43 (s, 6H, C (CH3)2); 13C NMR (DMSO-d6, 100 MHz) δ: 17.36, 18.31, 26.54, 44.57, 54.49, 120.29, 121.28, 121.48, 122.37, 123.63, 125.85, 126.45, 127.51, 132.97, 133.56, 137.57, 140.03, 147.57, 149.08, 163.35, 167.14. HRMS calcd for C22H23F7N3O2S [M+H]+ 526.1394, found 526.1396.
N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(N-氰基-S-甲基硫亚胺基)-2-甲基异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ig):白色固体, 产率93.74%. m.p. 88~90 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 9.95 (s, 1H, Ar-NH), 8.72 (d, J=4.0 Hz, 1H, Ar-H), 8.64 (s, 1H, CNH), 8.06 (d, J= 7.6 Hz, 1H, Ar-H), 7.94 (d, J=8.3 Hz, 1H, Ar-H), 7.72 (dd, J=7.4, 4.9 Hz, 1H, Ar-H), 7.54 (d, J=12.2 Hz, 2H, Ar-H), 3.83 (d, J=13.6 Hz, 1H, SCH2), 3.48 (d, J=13.7 Hz, 1H, SCH2), 2.78 (s, 3H, SCH3), 2.37 (s, 3H, ArCH3), 1.57 (s, 3H, C (CH3)2), 1.53 (s, 3H, C (CH3)2); 13C NMR (DMSO-d6, 100 MHz) δ: 18.38, 26.81, 27.16, 30.99, 52.89, 56.64, 119.19, 121.44, 121.64, 122.09, 123.67, 125.91, 126.38, 127.54, 133.18, 133.40, 137.43, 139.99, 148.13, 149.16, 164.70, 166.98. HRMS calcd for C23H23F7N5O2S [M+H]+ 566.1455, found 566.1460.
N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(甲磺酰基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ih):白色固体, 产率75.23%. m.p. 76~78 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 9.95 (s, 1H, Ar-NH), 8.73 (d, J=3.3 Hz, 1H, Ar-H), 8.61 (s, 1H, CNH), 8.06 (d, J=7.1 Hz, 1H, Ar-H), 7.97 (d, J=8.3 Hz, 1H, Ar-H), 7.73 (dd, J=7.2, 4.7 Hz, 1H, Ar-H), 7.55 (d, J=13.4 Hz, 2H, Ar-H), 3.76 (s, 2H, SCH2), 3.00 (s, 3H, SCH3), 2.38 (s, 3H, ArCH3), 1.60 (s, 6H, C (CH3)2). HRMS calcd for C22H23F7N3O4S [M+H]+ 558.1292, found 558.1303.
(S)-N3-[2-甲基-4-(七氟异丙基-2-基) 苯基]-N2-[1-(甲磺酰基) 异丙基-2-基]吡啶-2, 3-二甲酰胺 (Ii):白色固体, 产率82.54%. m.p. 86 ~ 87 ℃; [α]D20 - 86.4 (c 0.5, MeOH); 1H NMR (DMSO-d6, 400 MHz) δ 9.93 (s, 1H, Ar-NH), 9.02 (d, J=8.6 Hz, 1H, Ar-H), 8.73 (d, J=3.2 Hz, 1H, Ar-H), 8.04 (d, J=7.4 Hz, 1H, Ar-H), 7.96 (d, J= 8.2 Hz, 1H, Ar-H), 7.74~7.69 (m, 1H, Ar-H), 7.55 (s, 1H, Ar-H), 7.52 (s, 1H, CNH), 4.54~4.53 (m, 1H, NCH), 3.62 (dd, J=14.3, 7.8 Hz, 1H, SCH2), 3.30 (dd, J=15.2, 4.8 Hz, 1H, SCH2), 2.98 (s, 3H, SCH3), 2.36 (s, 3H, ArCH3), 1.30 (d, J=6.5 Hz, 3H, CCH3); 13C NMR (DMSO-d6, 100 MHz) δ: 17.92, 20.76, 40.74, 41.47, 58.35, 120.38, 120.90, 121.11, 123.19, 125.49, 126.07, 127.06, 132.62, 133.59, 136.99, 139.63, 147.03, 148.73, 163.08, 166.73. HRMS calcd for C21H21F7N3O4S [M + H] + 544.1136, found 544.1142.
3.2.1 中间体的合成
中间体1、4和5的合成参照文献[5~9], 产品经过分离纯化后进行下一步反应.
中间体3参照文献[10~14]合成.在500 mL三颈烧瓶中加入L-氨基丙醇 (133 mmol) 和少量乙二醇二甲醚, 机械搅拌使其混合均匀.在冷泵内控制温度在0 ℃以下, 缓慢加入氯磺酸 (133 mmol), 滴加完毕后反应结束, 旋蒸除去溶剂, 得白色固体粉末22.3 g.在500 mL三颈烧瓶中加入20%甲硫醇钠溶液 (0.172 mmol), 搅拌的条件下加入氢氧化钠 (0.287 mmol), 完全溶解后, 分数次加入白色固体粉末 (0.334mmol), 缓慢升温至90 ℃, 反应10 h, 萃取并干燥上方油层, 旋蒸除去溶剂, 得目标化合物3.
-
-
[1]
George, L. P.; Thomas, S. M.; Thomas, S. P.; John, F. H.; Daniel, C.; Lindsey, F.; Cheryl, B. A.; Christine, D. M.; Ben, S. K.; Kenneth, H. A.; Hollingshaus, J. G.; Christopher, C. E.; Eric, B. A. Bioorg. Med. Chem. Lett. 2007, 17, 6274. doi: 10.1016/j.bmcl.2007.09.012
-
[2]
Hughes, K. A.; Lahm, G. P.; Selby, T. P.; Stevenson, T. M. WO 2004067528, 2004[Chem. Abstr. 2004, 141, 190786].
-
[3]
Lahm, G. P.; Cordova, D.; Barry, J. D. Bioorg. Med. Chem. 2009, 17, 4127. doi: 10.1016/j.bmc.2009.01.018
-
[4]
李云, 郭佳佳, 韩枫, 胡猛, 安徽化工, 2015, 6, 3. doi: 10.3969/j.issn.1008-553X.2015.04.002Li, Y.; G, J.-J.; Han, F.; Hu, M. Anhui Chem. Ind. 2015, 6, 3 (in Chinese). doi: 10.3969/j.issn.1008-553X.2015.04.002
-
[5]
Zhou, S.; Jia, Z.-H.; Xiong, L.-X.; Yan, T.; Yang, N.; Wu, G.-P.; Song, H.-B.; Li, Z.-M. J. Agric. Food Chem. 2014, 62(27), 6269. doi: 10.1021/jf501727k
-
[6]
Zhou, S.; Gu, Y.-C.; Liu, M.; Wu, C.-C.; Zhao, Y.; Jia, Z.-H.; Wang, B.-L.; Xiong, L.-X.; Yang, N.; Li, Z.-M. J. Agric. Food Chem. 2014, 62(46), 11054. doi: 10.1021/jf503513n
-
[7]
Zhou, S.; Yan, T.; Li, Y.-X.; Jia, Z.-H.; Wang, B.-L; Zhao, Y.; Qiao, Y.-Y.; Xiong, L.-X.; Li, Y.-Q.; Li, Z.-M. Org. Biomol. Chem. 2014, 12, 6643. doi: 10.1039/C4OB00716F
-
[8]
Zhou, S.; Yan, T.; Zhou, S.; Hua, X.-W.; Wang, B.-L.; Gu, Y.-C.; Xiong, L.-X.; Li, Y.-Q.; Li, Z.-M. Chin. J. Chem. 2014, 32(7), 567. doi: 10.1002/cjoc.201400223
-
[9]
Gnamm, C.; Jeanguenat, A.; Dutton, A. C.; Grimm, C.; Kloer, D. P.; Crossthwaite, A. J. Bioorg. Med. Chem. Lett. 2012, 22, 3800. doi: 10.1016/j.bmcl.2012.03.106
-
[10]
Sergiy, P. WO 2007022900, 2007[Chem. Abstr. 2004, 146, 273965].
-
[11]
Masanobu, O.; Akihiko, Y.; Eiji, K. EP 1006102, 2000[Chem. Abstr. 2004, 133, 30570].
-
[12]
Graham, A. J.; Yang, S.; William, D. A. Eur. J. Med. Chem. 2002, 37, 825. doi: 10.1016/S0223-5234(02)01406-X
-
[13]
Soucy, C.; Favreau, D.; Kayser, M. M. J. Org. Chem. 1987, 52, 129. doi: 10.1021/jo00377a023
-
[14]
Wei, R.-B.; Li, S.-W.; Lu, J.-K.; Zheng, S.-H.; Hu, W.-H. Dyest. Ind. 2000, 37, 16.
-
[15]
Michael, L. R.; Benjamin, N. M.; Jim, H. X.; Richard, R. B.; Zhu, Y. M.; James, R. M.; Vidyadhar, H. B.; Joseph, D. J. WO 2007095229, 2007[Chem. Abstr. 2007, 147, 270793].
-
[16]
David E, P.; Rnonald, R.; James R, M. US 20080207910, 2008[Chem. Abstr. 2008, 149, 307682].
-
[17]
Douglas C, B.; Timothy J, A.; David E, P. US 8193222, 2012[Chem. Abstr. 2012, 157, 45017].
-
[18]
Huang, J.-X.; Rogers, R. B.; Orr, N. WO 2007149134, 2007[Chem. Abstr. 2007, 148, 47562].
-
[19]
吴益东, 沈晋良, 陈进, 林祥文, 李爱玫, 植物保护, 1996, 22, 3.Wu, Y.-D.; Shen, J.-L.; Chen, J.; Lin, X.-W.; Li, A.-M. Plant Prot. 1996, 22, 3 (in Chinese).
-
[20]
Busivine, J. R. FAO Plant Production and Protection Paper 21, FAO, Rome, 1980, p. 3.
-
[1]
-
表 1 目标化合物对东方粘虫的杀虫活性 (%)
Table 1. Larvicidal activity (%) against oriental armyworm of title compounds
Compd. c/(mg•L-1) 100 50 25 10 5 2.5 1 Ia 100 60 Ib 40 Ic 100 100 60 Id 100 100 100 20 Ie 100 100 40 If 100 100 100 20 Ig 100 50 Ih 100 100 100 20 Ii 100 100 60 A 100 100 100 100 100 100 40 B 100 100 100 100 100 100 100 C 100 100 100 100 60 D 100 100 100 100 100 100 100 E 100 100 100 100 100 100 100 Flubendiamide 100 100 100 100 100 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 946
- HTML全文浏览量: 77


 下载:
下载:


 下载:
下载:

