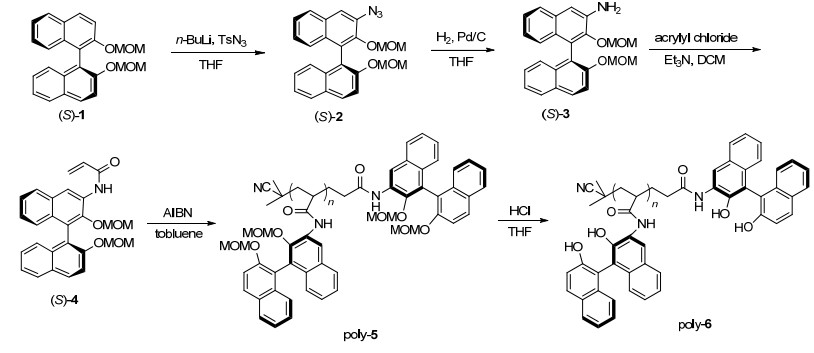
 图 图式1
聚合物poly-6的合成
Figure 图式1.
Synthetic route of poly-6
图 图式1
聚合物poly-6的合成
Figure 图式1.
Synthetic route of poly-6

Citation: Zhang Xun, Yang Nianfa. Poly[(S)-3-acrylamide-2, 2'-dihydroxy-1, 1'-binaphthyl]: Synthesis and Application in the Asymmetric Addition of Diethylzinc to Aromatic Aldehydes[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 1027-1032. doi: 10.6023/cjoc201611027

聚[(S)-3-丙烯酰胺基-2, 2'-二羟基-1, 1'-联萘]的合成及催化二乙基锌与芳基醛不对称加成反应中的应用
-
关键词:
- 聚丙烯酰胺
- / 1, 1'-联二萘酚
- / 二乙基锌
- / 芳基醛
- / 不对称加成
English
Poly[(S)-3-acrylamide-2, 2'-dihydroxy-1, 1'-binaphthyl]: Synthesis and Application in the Asymmetric Addition of Diethylzinc to Aromatic Aldehydes
-
Key words:
- polyacrylamide
- / 1, 1'-bi-2-naphthol
- / Et2Zn
- / aromatic aldehydes
- / asymmetric addition
-
手性仲醇是合成许多手性药物与天然产物的重要中间体[1], Et2Zn与醛的不对称加成反应是获得手性仲醇的重要手段之一[2].迄今为止, 尽管有许多性能优异的手性小分子催化剂被设计和合成出来, 但由于聚合物催化剂具有产物分离简单, 容易回收利用等优势, 因此开发具有良好溶解性的手性聚合物催化剂引起了化学家们的广泛关注[3].同时, 聚合物催化剂的使用也让大规模的流动反应器反应成为一种可能.近年来, 基于联萘侧基修饰的不同种类聚合物被不断合成出来, 研究表明该类催化剂具有不逊于小分子催化剂的催化活性[4~6], 因此对于这种经济、高效和环保的手性催化剂的研究对于绿色化学理念有着深远的意义.
手性联萘酚及其衍生物配体在不对称烷基化[7]、不对称氢化[8]、不对称双羟基化[9]、不对称Diels-Alder反应[10]、不对称傅克酰基化[11]、不对称曼尼希缩合[12]、不对称烯烃环氧化[13]等反应中展现较好的催化性能.迄今为止, 没有基于手性联萘侧基的聚丙烯酰胺聚合物配体催化Et2Zn与醛的不对称加成反应的报导, 因此我们首先合成了一种基于手性联萘酚侧基的新型聚合物聚[(S)-3-丙烯酰胺基-2, 2'-二羟基-1, 1'-联萘](poly-6), 并将其应用于诱导Et2Zn和芳香醛的不对称加成反应.
1 结果与讨论
1.1 基于联萘侧基的丙烯酰胺聚合物配体的合成
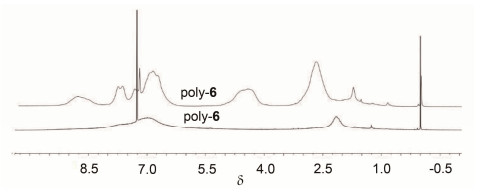
我们合成了新型的单体 (S)-3-丙烯酰胺基-2, 2'-二羟基-1, 1'-联萘, 并将其通过以偶氮二异丁腈 (AIBN) 为引发剂的自由基聚合反应制得poly-5 (Mn=25100, PDI=Mw/Mn=1.31, n=56), poly-5在浓盐酸的作用下脱去保护基 (MOM) 得到poly-6 (Mn=20100, PDI=Mw/Mn=1.35, n=56).详见合成路线Scheme 1.对比poly-5和poly-6的1H NMR谱图 (图 1) 可以发现, poly-6在δ 2.3~3.1和4.0~5.2信号峰消失, 表明poly-5上的保护基 (MOM) 已经完全脱除.
1.2 二乙基锌与芳基醛的不对称加成反应
1.2.1 二乙基锌与芳基醛不对称加成反应的条件优化
以苯甲醛为底物进行条件探索, 首先, 对溶剂进行筛选, 以二氯甲烷 (DCM) 作熔剂时, 产物的产率和ee值最好, 分别为95%和73%(表 1, Entry 1).接着我们以DCM为溶剂考察poly-6用量对该反应的影响, 确定当poly-6用量为20 mol%时产率和ee相对较好, 为90%和77%(表 1, Entry 1, Entries 4~6).然后我们以DCM为溶剂, 20 mol%的配体为条件对Ti (O-i-Pr)4的用量进行探索, 当Ti (O-i-Pr)4用量为140 mol%时, 产物的ee值最高80%(表 1, Entry 7).温度考察结果表明反应的最佳温度为0℃(表 1, Entry 7, Entries 10~11).反应时间及Et2Zn的用量也会影响该反应, 当反应时间为36和12 h时产率分别为96%和65%.当Et2Zn的用量为2 equiv.时产率仅有53%(表 1, Entries 12~14).此外, 我们也对聚合物poly-6的单体单元类似物 (S)-3c催化性能进行考察, 产物的产率和ee值与poly-6的相近, 但由于聚合物poly-6具有容易与产物分离、且可以回收重复利用多次等优越性.我们选定该反应的最佳条件为: n(醛):n[Ti (O-i-Pr)4]:n(ZnEt2):n(poly-6)=1.4:1:3:0.2.
 表 1
聚合物配体poly-6催化苯甲醛与二乙基锌不对称加成a
Table 1.
Asymmetric reaction of Et2Zn with benzaldehyde catalyzed by poly-6
表 1
聚合物配体poly-6催化苯甲醛与二乙基锌不对称加成a
Table 1.
Asymmetric reaction of Et2Zn with benzaldehyde catalyzed by poly-6

Entry Poly-6/mol% Ti (O-i-Pr)4b Yield/% eec/% 1 10 1.2 95 73 2d 10 1.2 86 68 3e 10 1.2 85 65 4 5 1.2 97 63 5 20 1.2 90 77 6 30 1.2 82 71 7 20 1.4 93 80 8 20 2.0 87 75 9 20 0 19 8 10f 20 1.4 91 76 11g 20 1.4 86 78 12h 20 1.4 65 75 13i 20 1.4 96 80 14j 20 1.4 53 70 15 0 1.4 90 0 16k 20 1.4 92 81 a Reaction condition: 1 mol of benzaldehyde, 3.0 equiv. of Et2Zn, in DCM, 0 ℃, 24 h; b isolated yields; c Determined by HPLC with a Chiralcel OD-H column; d toluene was used as solvent; e THF was used as solvent; f the reaction was carried out at room temperature; g the reaction temperature was -20 ℃; h 12 h; i 36 h; j 2.0 equiv. Et2Zn was used. k (S)-3c was used as ligand. 表 1 聚合物配体poly-6催化苯甲醛与二乙基锌不对称加成a
Table 1. Asymmetric reaction of Et2Zn with benzaldehyde catalyzed by poly-61.2.3 聚合物poly-6的回收重复利用实验
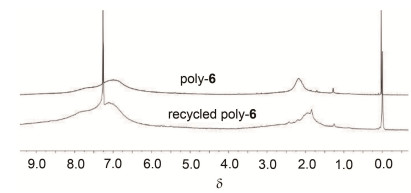
将回收的聚合物poly-6 (2 g) 溶于20 mL四氢呋喃中, 过滤除去不溶物, 滤液倒100 mL甲醇中, 析出固体, 抽滤, 将滤渣用甲醇洗涤两次, 40℃真空干燥8 h即得回收配体, 配体回收利用7次的收率分别为98%、99%、96%、97%、98%、96%、98%.将回收的聚合物poly-6再次用于催化二乙基锌与苯甲醛的不对称加成反应, 结果如表 3所示, 循环使用6次产物的转化率和ee值没有明显变化, 当回收的配体重复使用6次时, 加成产物的转化率和ee值明显降低, 分别为78%和63%.对比poly-6和回收利用后的poly-6的1H NMR谱图 (图 2) 也发现信号峰δ 1.8~2.3的峰形发生微弱变化.上述结果表明poly-6可重复利用6次其催化活性没有明显降低.

Cycle 1 2 3 4 5 6 7 Yieldb/% 93 90 91 93 90 89 78 eec/% 80 79 78 80 78 75 63 a Reaction condition: 20 mol% poly-6 (calculated by monomer), 1.0 mmol of aldehyde, 3.0 mmol of Et2Zn, 1.4 mmol of Ti (O-i-Pr)4, in 3 mL of DCM at 0 ℃ for 24 h. b Isolated yield. c Determined by HPLC using a Chiralcel OD-H column. 表 3 聚合物poly-6的回收利用a
Table 3. The recycled and reused of poly-61.2.2 底物拓展
基于上述实验得出的最优条件, 我们分别将不同的醛应用到这个反应中来, 3, 4-二甲氧基苯甲醛时产物的ee值最高为95%(表 2, Entries 9).当苯甲醛的对位有吸电子的F、Cl、Br、NO2等取代基时产物的ee值有所增加 (表 2, Entries 2~5).对于苯环上存在给电子取代基的苯甲醛也显示了较好的活性, 得到82%~89%的ee值 (表 2, Entries 6~10).当底物为带芳基的脂肪苯丙醛和肉桂醛时, poly-6的诱导作用有所降低, ee值分别为66%和73%(表 2, Entries 12~13).当底物为大位阻的1-萘醛、2-萘醛、对苯基苯甲醛时活性也较高, ee值分别为90%、86%、91%(表 2, Entries 14~16).以上实验结果表明, 聚合物poly-6对大多数芳基醛都显示了较好的手性诱导作用, 具有较广泛的底物适应性.
 表 2
聚合物配体poly-6催化不同种类的醛与二乙基锌的不对称加成反应a
Table 2.
Enantioselective addition of Et2Zn to various aromatic aldehydes catalyzed by Poly-6
表 2
聚合物配体poly-6催化不同种类的醛与二乙基锌的不对称加成反应a
Table 2.
Enantioselective addition of Et2Zn to various aromatic aldehydes catalyzed by Poly-6

Entry R Yieldb/% ee/% Conf.c 1 Ph 93 80 S 2 4-FC6H4 90 85 S 3 4-ClC6H4 87 90 S 4 4-BrC6H4 94 86 S 5 4-O2NC6H4 86 90 S 6 2-MeOC6H4 91 82 S 7 3-MeOC6H4 89 83 S 8 4-MeOC6H4 90 89 S 9 p-MeC6H4 95 88 S 10 3, 4-(MeO)2C6H4 92 95 S 11 C6H4CH2CH2 97 66 S 12 C6H5CH=CH 95 73 S 13 2-FC6H4 89 83 S 14 1-Naphthyl 92 90 S 15 2-Naphthyl 90 86 S 16 4-Biphenyl 93 91 S a Reaction condition: 20 mol% poly-6 (calculated by monomer), 1.0 mmol of aldehyde, 3.0 mmol of Et2Zn, 1.4 mmol of Ti (O-i-Pr)4, in 3 mL of DCM at 0 ℃ for 24 h.bIsolated yield. c Determined by HPLC using a Chiralcel OD-H column. d Absolute configurations were determined by comparison with the sign of specific rotations reported in the literature.[14~21] 表 2 聚合物配体poly-6催化不同种类的醛与二乙基锌的不对称加成反应a
Table 2. Enantioselective addition of Et2Zn to various aromatic aldehydes catalyzed by Poly-62 结论
我们通过自由基聚合制备了一种基联萘侧基的新型聚合物配体聚[(S)-3-丙烯酰胺基-2, 2'-二羟基-1, 1'-联萘], 并将其应用于二乙基锌与芳香醛的不对称加成反应中, 加成产物具有较好的对映选择性, ee值最高可达95%. Poly-6可以重复利用6次且催化活性没有明显降低.
3 实验部分
3.1 仪器与试剂
1H NMR和13C NMR以CDCl3作溶剂, TMS作内标在Bruker公司的AV-400核磁共振仪上测试; 比旋光度在PerkinElmer Polarmeter model 341上测试; 熔点使用巩义市予华仪器公司X-4型显微熔点仪测得; 产物的ee值经高效液相色谱分析: Dionex P680 HPLC, Chiracel: emoji: OD-H (Daicel Chemical Ind., Ltd, 25 cm×0.46 cm), 流动相为正己烷和异丙醇, 手性柱OD-H, 柱温25 ℃.实验中的四氢呋喃和甲苯经钠/二苯甲酮干燥, DCM经氢化钙干燥后使用.所有反应均在氩气保护下进行.
3.2 实验方法
3.2.6 催化二乙基锌与芳基醛的不对称加成一般步骤
氩气保护0 ℃下, 往poly-6 (71.08 mg, 0.2 mmol) 的DCM溶液中滴入Ti (O-i-Pr)4 (0.47 mL, 1.4 mmol), 将反应混合物置于室温下继续反应15 min, 然后转移到冰水浴中, 缓慢滴入Et2Zn (3 mL, 1 mol/L in toluene, 3 mmol), 室温下反应0.5 h后降温至0 ℃, 缓慢滴加相应的醛后在该温度下继续反应24 h.滴入饱和NH4Cl溶液 (1 mL) 淬灭反应后过滤, 滤液经无水MgSO4干燥后减压蒸馏除去溶剂经柱层析法纯化得目标产物[14~21].
辅助材料 (Supporting Information)化合物 (S)-3, (S)-4, poly-5, poly-6, (S)-3b, (S)-3c及催化产物的的核磁图谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
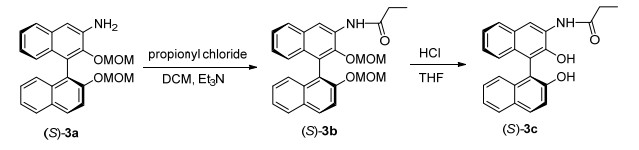
3.2.2 (S)-3-丙烯酰胺基-2, 2'-二甲氧基甲氧基-1, 1'-联萘[(S)-4]的合成
在0 ℃下, 往溶有 (S)-3 (2.50 g, 6.4 mmol) 的无水DCM (20 mL) 溶液中滴入5~6滴三乙胺 (Et3N), 然后向反应混合物中缓慢地加丙烯酰氯 (0.58 mL, 7, 04 mmol, 1.1 equiv.), 0 ℃下继续反应1 h, 用10 mL 10% NaHCO3水溶液淬灭反应, 分出有机相, 水相用乙酸乙酯萃取 (15 mL×2), 合并有机相并用无水MgSO4干燥, 滤液经减压蒸馏出去溶剂后剩余物经柱层析[洗脱剂: V(甲醇):V(DCM)=1:45]分离得白色固体 (S)-4 (2.55 g, 产率90%). m.p. 61.5~63.8℃; [α]20 D-476 (c 0.1, THF); 1H NMR (400 MHz, CDCl3) δ: 9.12 (s, 1H), 8.78 (s, 1H), 7.98 (d, J=9.0 Hz, 1H), 7.94~7.81 (m, 2H), 7.58 (d, J=9.0 Hz, 1H), 7.38 (dd, J=15.2, 7.9 Hz, 2H), 7.30~7.21 (m, 1H), 7.13 (dd, J=29.7, 9.8 Hz, 3H), 6.49 (d, J=16.9 Hz, 1H), 6.32 (dd, J=16.8, 10.2 Hz, 1H), 5.80 (d, J=10.1 Hz, 1H), 5.12 (d, J=6.8 Hz, 1H), 5.01 (d, J=6.8 Hz, 1H), 4.67 (d, J=5.8 Hz, 1H), 4.54 (d, J=5.7 Hz, 1H), 3.25 (s, 3H), 3.13 (s, 3H); 13C NMR (100 MHz) δ: 163.78, 152.76, 145.40, 133.82, 131.78, 131.53, 130.70, 130.31, 130.20, 129.78, 128.17, 128.13, 127.45, 126.98, 125.78, 125.62, 125.57, 125.39, 125.30, 124.41, 119.91, 118.03, 116.66, 100.11, 94.98, 77.57, 77.28, 76.96, 57.34, 56.04.
3.2.4 聚[(S)-3-丙烯酰胺基-2, 2'-二羟基-1, 1'-联萘] (poly-6) 的合成
0 ℃下, 往poly-5 (2.42 g) 的THF (100 mL) 溶液中缓慢滴加浓盐酸 (4 mL), 然后升温至室温反应24 h, 用10%的NaHCO3 (100 mL) 水溶液淬灭反应.分出有机相, 水相用DCM萃取 (20 mL×2), 合并有机相, 减压蒸馏出去大部分溶剂后将混合物滴入到甲醇 (100 mL) 中, 此时大量固体析出, 抽滤, 收集滤渣既得poly-6 (1.86 g, 收率96%). [α]20 D-425 (c 0.1, THF); Mn=2.01×104, PDI=Mw/Mn=1.35. 1H NMR (400 MHz, CDCl3) δ: 6.92 (br), 1.93 (br), 1.26 (br), 0.83 (br).
3.2.1 (S)-3-氨基-2, 2'-二甲氧基甲氧基-1, 1'-联萘[(S)-3]的合成
在0 ℃, 氩气保护下, 往溶有 (S)-2, 2'-二甲氧基甲氧基-1, 1'-联萘 (5.01 g, 13.4 mmol, 1.0 equiv.) 的四氢呋喃 (THF) 100 mL溶液中缓慢滴入n-BuLi (8.10 mL, 2.5 m in n-hexane, 20.1 mmol, 1.5 equiv.).滴完后反应混合物室温反应2.5 h.然后将体系降温至0 ℃缓慢地滴加对甲苯磺酰叠氮 (4.78 g, 24.1 mmol, 1.8 equiv.), 在该温度下继续反应1 h后升温至室温反应12 h.用10 mL饱和氯化铵 (NH4Cl) 水溶液淬灭, 蒸出大部分溶剂, 残余物用乙酸乙酯80 mL溶解, 用饱和食盐水洗涤 (20 mL×3), 分出有机相并将其用无水Na2SO4干燥1 h.减压蒸馏去除溶剂, 剩余固体物用THF溶解后, 往反应混合物一次性加入5%钯碳 (0.17 g), 混合物在氢气氛围下反应24 h后过滤除去钯碳, 滤液蒸除溶剂所得剩余物经柱层析[洗脱剂: V(乙酸乙酯):V(石油醚)=1:4]分离得黄色固体 (S)-3 (3.13 g, 产率60%). m.p. 48.3~51.5℃; 1H NMR (400 MHz, CDCl3) δ: 7.94 (d, J=9.0 Hz, 1H), 7.85 (d, J=8.0 Hz, 1H), 7.62 (d, J=8.1 Hz, 1H), 7.57 (d, J=9.0 Hz, 1H), 7.34 (t, J=7.0 Hz, 1H), 7.23 (dd, J=20.8, 8.5 Hz, 3H), 7.17 (s, 1H), 7.08~6.92 (m, 2H), 5.10 (d, J=6.8 Hz, 1H), 5.01 (d, J=6.8 Hz, 1H), 4.64 (d, J=5.5 Hz, 1H), 4.57 (d, J=5.5 Hz, 1H), 4.27 (s, 2H), 3.16 (s, 3H), 3.00 (s, 3H); 13C NMR (101 MHz) δ: 154.77, 146.32, 139.87, 134.16, 131.86, 129.52, 129.13, 128.26, 127.83, 126.54, 125.68, 125.58, 125.21, 124.87, 123.63, 122.37, 115.44, 109.37, 77.40, 77.11, 76.79, 68.38, 65.12,
3.2.5 (S)-3-丙酰胺基-2, 2'-二羟基-1, 1'-联萘[(S)-3c]的合成
0 ℃下, 往 (S)-3b (1.10 g, 3.1 mmol) 的THF溶液中缓慢滴加浓盐酸 (1 mL), 然后升温至室温反应24 h, 用10%的NaHCO3 (20 mL) 水溶液淬灭反应.分出有机相, 水相用乙酸乙酯萃取 (20 mL×2), 合并有机相并用无水MgSO4干燥, 过滤, 滤液经减压蒸馏除去溶剂后剩余物经柱层析[洗脱剂: V(乙酸乙酯):V(石油醚)=1:4]分离得白色固体 (S)-3c (0.75 g, 收率85%). m.p. 65.3~68.6℃; [α]20 D-475 (c 0.1, THF); 1H NMR (400 MHz, CDCl3) δ: 8.80 (s, 1H), 8.00 (s, 1H), 7.88 (d, J=8.9 Hz, 1H), 7.80 (dd, J=12.5, 8.1 Hz, 2H), 7.35~7.21 (m, 5H), 7.16 (t, J=7.7 Hz, 1H), 7.10 (d, J=8.3 Hz, 1H), 7.04 (d, J=8.3 Hz, 1H), 6.08 (s, 1H), 5.72 (s, 1H), 2.40~2.21 (m, 2H), 1.15 (t, J=7.5 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 172.67, 152.67, 143.17, 133.30, 131.11, 129.52, 129.41, 129.15, 128.16, 128.12, 127.22, 126.75, 125.91, 124.46, 124.05, 123.87, 123.76, 118.53, 117.87, 112.25, 111.03, 77.22, 76.90, 76.58, 30.78, 9.40.
3.2.3 聚[(S)-3-丙烯酰胺基-2, 2'-二甲氧基甲氧基-1, 1'-联萘](poly-5) 的合成
将 (S)-4 (3.04 g 3.38 mmol), AIBN (77.6 mg, 0.48 mmol) 和甲苯 (5 mL) 加入到洁净的Schlenk瓶中, 氩气保护75 ℃条件下反应24 h.反应冷却至室温后将混合物滴入80 mL甲醇中, 此时大量固体析出, 将其抽滤并收集滤渣, 滤渣干燥后得poly-5 (2.88 g, 收率95%). [α]20 D-427 (c 0.1, THF); Mn=2.51×104, PDI=Mw/Mn=1.31. 1H NMR (400 MHz, CDCl3) δ: 8.82 (br), 7.81 (br), 7.69 (br), 7.38 (br), 6.90 (br), 4.4 (br), 2.68 (br), 1.74 (br).
3.2.4 (S)-3-丙酰胺基-2, 2'-二甲氧基甲氧基-1, 1'-联萘[(S)-3b]的合成
在0 ℃下, 往溶有 (S)-3 (1.20 g, 3.1 mmol) 的无水DCM (10 mL) 溶液中滴入2~3滴Et3N, 然后向该反应混合物中缓慢地加丙酰氯 (0.30 mL, 3.4 mmol, 1.1 equiv.) 0 ℃下反应混合物继续反应1 h后用10 mL 10%碳酸钠溶液淬灭反应, 分出有机相, 水相用乙酸乙酯萃取 (15 mL×2), 合并有机相并用无水MgSO4干燥, 滤液经减压蒸馏出去溶剂后剩余物经柱层析[洗脱剂: V(乙酸乙酯):V(石油醚)=1:5]分离得白色固体 (S)-3b (1.34 g, 收率95%). m.p. 60.5~62.8℃; [α]20 D-473 (c 0.1, THF); 1H NMR (400 MHz, CDCl3) δ: 9.03 (s, 1H), 8.61 (s, 1H), 7.94 (d, J=9.0 Hz, 1H), 7.87~7.81 (m, 2H), 7.56 (d, J=9.1 Hz, 1H), 7.36~7.30 (m, 2H), 7.25~7.20 (m, 1H), 7.20~7.15 (m, 1H), 7.14~7.04 (m, 3H), 6.85 (dd, J=16.9, 8.8 Hz, 1H), 5.08 (d, J=6.9 Hz, 1H), 4.98 (d, J=6.9 Hz, 1H), 4.67~4.62 (m, 1H), 4.53~4.49 (m, 1H), 3.20 (s, 3H), 3.09 (s, 3H), 2.48 (q, J=7.6 Hz, 2H), 1.29 (t, J=7.5 Hz, 3H); 13C NMR (101 MHz, CDCl3) δ: 172.29, 152.55, 144.94, 133.59, 131.37, 130.54, 129.96, 129.82, 129.56, 129.34, 127.85, 126.73, 125.46, 125.27, 125.20, 125.09, 124.95, 124.17, 119.91, 117.36, 116.48, 115.33, 99.90, 94.85, 77.29, 76.97, 76.59, 56.83, 55.36, 31.04, 9.51.
-
-
[1]
Soai, K.; Niwa, S. Chem. Rev. 1992, 92, 833. doi: 10.1021/cr00013a004
-
[2]
郑龙生, 宋涛, 徐利文, 有机化学, 2014, 34, 1255. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344568.shtmlZheng, L. S.; Song, T.; Xu, L. W. Chin. J. Org. Chem. 2014, 34, 1255 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344568.shtml
-
[3]
(a) Yu, H. B.; Hu, Q. S.; Pu. L. J. Am. Chem. Soc. 2000, 122, 6500.
(b) Yamago, S.; Furukawa, M.; Azuma, A.; Yoshida, J. I. Tetrahedron Lett. 1998, 39, 3783.
(c) Rheiner, P. B.; Seebach, D. Chem. Eur. J. 1999, 5, 3221.
(d) Hu, Q. S.; Pugh, V.; Sabat, M.; Pu, L. J. Org. Chem. 1999, 64, 7528.
(e) Kollner, C.; Pugin, B.; Togni, A. J. Am. Chem. Soc. 1998, 120, 10274. -
[4]
刘大财, 朱维君, 张安林, 阳年发, 杨利文, 有机化学, 2015, 35, 1797. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344941.shtmlLiu, D. C.; Zhu, W. J.; Zhang, A. L.; Yang, N. F.; Yang, L. W. Chin. J. Org. Chem. 2015, 35, 1797 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344941.shtml
-
[5]
Arai, T.; Hu, Q. S.; Zheng, X. F.; Pu, L.; Sasai, H. Org. Lett. 2000, 2, 4261. doi: 10.1021/ol006837g
-
[6]
Zhang, A. L.; Yu, Z. D.; Yang, N. F.; Yang, L. W. Tetrahedron: Asymmetry 2015, 26, 173. doi: 10.1016/j.tetasy.2014.12.012
-
[7]
(a) Harada, T.; Kanda, K. Org. Lett. 2006, 8, 3817.
(b) Chen, Y. H.; Qin, G. C.; Yang, L. W.; Yang, N. F. Chin. J. Chem. 2015, 33, 463.
(c) Chen, Y. H.; Cheng, D. J.; Zhang, J.; Wang, Y.; Liu, X. Y.; Tan, B. J. Am. Chem. Soc, 2015, 137, 15062. -
[8]
Reetz, M. T.; Mehler, G. Angew. Chem., Int. Ed. 2000, 39, 3889. doi: 10.1002/(ISSN)1521-3773
-
[9]
Kumagai, N.; Matsunaga, S.; Kinoshita, T.; Harada, S.; Okada, S.; Sakamoto, S.; Yamaguchi, K.; Shibasaki, M. J. Am. Chem. Soc. 2003, 125, 2169. doi: 10.1021/ja028926p
-
[10]
Nakashima, D.; Yamamoto, H. J. Am. Chem. Soc. 2006, 128, 9626. doi: 10.1021/ja062508t
-
[11]
Ishii, A.; Soloshonok, V. A.; Mikami, K. J. Org. Chem. 2000, 65, 1597. doi: 10.1021/jo991691o
-
[12]
Akiyama, T.; Itoh, J.; Yokota, K.; Fuchibe, K. Angew. Chem., Int. Ed. 2004, 43, 1566. doi: 10.1002/(ISSN)1521-3773
-
[13]
Chen, Y.; Yekta, S.; Yudin, A. K. Chem. Rev. 2003, 103, 3155. doi: 10.1021/cr020025b
-
[14]
Gou, S. H.; Judeh, Z. M. A. Tetrahedron Lett. 2009, 50, 281. doi: 10.1016/j.tetlet.2008.10.149
-
[15]
Yang, X. W.; Sheng, J. H.; Da, C. S.; Wang, H. S.; Su, W.; Wang, R.; Chan, A. S. C. J. Org. Chem. 2000, 65, 295. doi: 10.1021/jo990771p
-
[16]
Sokeirik, Y. S.; Omote, M.; Sato, K.; Kamadaki, I.; Ando, A. Tetrahedron: Asymmetry 2006, 17, 2654. doi: 10.1016/j.tetasy.2006.08.023
-
[17]
Priego, J.; Mancheno, O. G.; Cabrera, S.; Carretero, J. C. J. Org. Chem. 2002, 67, 1346. doi: 10.1021/jo016271p
-
[18]
Tanaka, T.; Yasuda, Y.; Hayashi, M. J. Org. Chem. 2006, 71, 7091. doi: 10.1021/jo060964u
-
[19]
Cabrera, S.; Carretero, J. C. Chem. Commun. 2001, 2026.
-
[20]
Manabu, H.; Takashi, M.; Kazuaki, I. J. Org. Chem. 2006, 71, 6474. doi: 10.1021/jo060908t
-
[21]
Zhang, A. L.; Liu, Y. L.; Yang, N. F.; Yang, L. W. Tetrahedron: Asymmetry 2014, 24, 289.
-
[1]
-
表 1 聚合物配体poly-6催化苯甲醛与二乙基锌不对称加成a
Table 1. Asymmetric reaction of Et2Zn with benzaldehyde catalyzed by poly-6

Entry Poly-6/mol% Ti (O-i-Pr)4b Yield/% eec/% 1 10 1.2 95 73 2d 10 1.2 86 68 3e 10 1.2 85 65 4 5 1.2 97 63 5 20 1.2 90 77 6 30 1.2 82 71 7 20 1.4 93 80 8 20 2.0 87 75 9 20 0 19 8 10f 20 1.4 91 76 11g 20 1.4 86 78 12h 20 1.4 65 75 13i 20 1.4 96 80 14j 20 1.4 53 70 15 0 1.4 90 0 16k 20 1.4 92 81 a Reaction condition: 1 mol of benzaldehyde, 3.0 equiv. of Et2Zn, in DCM, 0 ℃, 24 h; b isolated yields; c Determined by HPLC with a Chiralcel OD-H column; d toluene was used as solvent; e THF was used as solvent; f the reaction was carried out at room temperature; g the reaction temperature was -20 ℃; h 12 h; i 36 h; j 2.0 equiv. Et2Zn was used. k (S)-3c was used as ligand. 表 2 聚合物配体poly-6催化不同种类的醛与二乙基锌的不对称加成反应a
Table 2. Enantioselective addition of Et2Zn to various aromatic aldehydes catalyzed by Poly-6

Entry R Yieldb/% ee/% Conf.c 1 Ph 93 80 S 2 4-FC6H4 90 85 S 3 4-ClC6H4 87 90 S 4 4-BrC6H4 94 86 S 5 4-O2NC6H4 86 90 S 6 2-MeOC6H4 91 82 S 7 3-MeOC6H4 89 83 S 8 4-MeOC6H4 90 89 S 9 p-MeC6H4 95 88 S 10 3, 4-(MeO)2C6H4 92 95 S 11 C6H4CH2CH2 97 66 S 12 C6H5CH=CH 95 73 S 13 2-FC6H4 89 83 S 14 1-Naphthyl 92 90 S 15 2-Naphthyl 90 86 S 16 4-Biphenyl 93 91 S a Reaction condition: 20 mol% poly-6 (calculated by monomer), 1.0 mmol of aldehyde, 3.0 mmol of Et2Zn, 1.4 mmol of Ti (O-i-Pr)4, in 3 mL of DCM at 0 ℃ for 24 h.bIsolated yield. c Determined by HPLC using a Chiralcel OD-H column. d Absolute configurations were determined by comparison with the sign of specific rotations reported in the literature.[14~21] 表 3 聚合物poly-6的回收利用a
Table 3. The recycled and reused of poly-6

Cycle 1 2 3 4 5 6 7 Yieldb/% 93 90 91 93 90 89 78 eec/% 80 79 78 80 78 75 63 a Reaction condition: 20 mol% poly-6 (calculated by monomer), 1.0 mmol of aldehyde, 3.0 mmol of Et2Zn, 1.4 mmol of Ti (O-i-Pr)4, in 3 mL of DCM at 0 ℃ for 24 h. b Isolated yield. c Determined by HPLC using a Chiralcel OD-H column. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1097
- HTML全文浏览量: 49


 下载:
下载:



 下载:
下载:

