
Citation: Peng Lifen, Jiang Juan, Peng Chao, Dai Ningning, Tang Zilong, Jiao Yinchun, Chen Jinyang, Xu Xinhua. Synthesis of Unsymmetrical Aromatic Acetylenes by Diphenyl Chlorophosphate-Promoted Condensation Reaction of Aromatic Aldehydes and Sulfones[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 3013-3018. doi: 10.6023/cjoc201704053

氯磷酸二苯酯介入的芳香醛与砜缩合制备非对称芳香炔烃
English
Synthesis of Unsymmetrical Aromatic Acetylenes by Diphenyl Chlorophosphate-Promoted Condensation Reaction of Aromatic Aldehydes and Sulfones
-
含有碳碳叁键官能团的炔烃由于其独特刚性直线结构在药物及光电材料等领域有广泛应用:刚性直线型亲脂性炔烃类衍生物具有一定的生物活性, 可用于抗菌抗癌等[1]; π共轭芳香炔烃刚性骨架具有丰富的π电子常常用于有机光电材料领域, 如苝酰亚胺类噻吩取代的炔烃聚合物可用于有机场效应晶体管(OFETs)装置[2], 芘-芴类芳香炔烃可用作有机发光二极管(OLED)中的发光材料[3], 全氟甲基取代的全氟苯基多炔有望获得在有机半导体材料中的应用[4], 茚并二萘嵌苯类炔烃可作为染料敏化太阳能电池(DSC)中的有机染料[5], 环内带有极性基团的大环多炔衍生物是一种性能优良的液晶材料[6], 咔唑类炔烃聚合物具有独特的红外和荧光性质, 在光电材料领域有潜在的应用价值[7].
芳香炔烃主要通过过渡金属催化的Sonogashira和Eglinton等偶联反应制备.官能团化的非对称芳香炔烃常需通过步骤繁琐且产物分离困难的炔烃硅基保护/偶联反应/脱硅基保护基/偶联反应制备[8].近年来, Otera和Orita等发展了合成官能团化非对称芳香炔烃的两种方法:一种是端炔的极性二苯基膦酰基(Ph2P(O))保护基法[9], 另一种是醛和砜缩合反应[10].此外, 去丙酮保护法[11]和C—H炔基化反应[12]亦能应用于高效制备炔烃类化合物.
碱/氯磷酸二乙酯[(EtO)2P(O)Cl]促进醛和砜缩合反应可有效地避免使用端炔保护基和反复脱保护/偶联反应, 无需使用过渡金属催化剂, 可快速高产率地合成官能团化的非对称芳香炔烃[13].此缩合反应常用的碱有二异丙基氨基锂(LDA)、叔丁基锂(t-BuLi)和六甲基二硅基氨基锂(LiHMDS)等[14].其中LiHMDS/(EtO)2P(O)Cl促进醛和砜的缩合反应无需分离中间体, 无需分批加入反应试剂, 反应一锅进行[15].
但是这一方法使用(EtO)2P(O)Cl试剂, 由于其极高的活泼性, 使反应需要在低温(-78 ℃)下进行, 这严重制约了其应用, 特别是规模化的工业生产.本文报道以氯磷酸二苯酯((PhO)2P(O)Cl)代替(EtO)2P(O)Cl, 在室温下促进的芳香醛和砜缩合反应.
1 结果与讨论
首先我们对比了(EtO)2P(O)Cl和(PhO)2P(O)Cl促进苯甲醛(1a)与苄基苯基砜(2a)的缩合反应.在-78 ℃下, 将LiHMDS和(EtO)2P(O)Cl滴加到1a和2a的THF溶液中, 室温下使反应进行完全, 得到了产率为95%的二苯基乙炔(3a)(表 1, Entry 1);当投料和反应在室温下进行时, 3a产率为63%~78%(表 1, Entries 2~5), 且四氢呋喃(THF)是最优溶剂.使用(PhO)2P(O)Cl代替(EtO)2P(O)Cl, 室温下加入LiHMDS和(PhO)2P(O)Cl, 反应5 h得到85%的产物3a(表 1, Entry 6);延长反应时间可将产率提高至94%(表 1, Entry 8).避免低温的最佳反应条件为:苯甲醛(1a)(1.0 mmol)、苄基苯基砜(2a)(1.2 mmol)、六甲基二硅基氨基锂(4.5 mmol)和氯磷酸二苯酯(1.2 mmol)在THF (5 mL)中氮气保护下室温反应12 h.
 表 1
对比(EtO)2P(O)Cl和(PhO)2P(O)Cl促进的缩合反应a
Table 1.
Comparison of (EtO)2P(O)Cl and (PhO)2P(O)Cl pro-moted condensation reaction
表 1
对比(EtO)2P(O)Cl和(PhO)2P(O)Cl促进的缩合反应a
Table 1.
Comparison of (EtO)2P(O)Cl and (PhO)2P(O)Cl pro-moted condensation reaction

Entry ClP(O)X2 Solvent Temp./℃ Time/h Yieldb/% 1 ClP(O)(OEt)2 THF -78~r.t. 5 95 2 ClP(O)(OEt)2 THF r.t. 5 72 3 ClP(O)(OEt)2 CH2Cl2 r.t. 5 63 4 ClP(O)(OEt)2 THF r.t. 10 78 5 ClP(O)(OEt)2 DMF r.t. 5 72 6 ClP(O)(OPh)2 THF r.t. 5 86 7 ClP(O)(OPh)2 THF r.t. 10 92 8 ClP(O)(OPh)2 THF r.t. 12 94 aReaction conditions: benzaldehyde (1a) (1.0 mmol), (benzylsulfonyl)benzene (2a) (1.2 mmol), solvent (5.0 mL). bIsolated yields. 上述缩合反应中, 我们在室温下剧烈搅拌下慢慢滴加过量强碱LiHMDS, 有放热现象, 但不足以引起反应液膨胀和爆沸, 反应安全可靠.
研究结果表明:相对于(EtO)2P(O)Cl, (PhO)2P(O)Cl促进的醛与砜缩合反应可在室温下有效进行, 且产率高.
接下来, 我们考察了醛和砜芳环上不同取代基对反应的影响, 研究结果如表 2所示.当醛和砜的苯环上含有供电子基(Me, MeO)时, 对应芳香炔烃可高产率地制备(表 2, Entries 1, 2, 3, 5, 7);醛和砜的苯环上含有吸电子基(Cl, I)时, 对应芳香炔烃也可高产率制得(表 2, Entries 4, 5, 9);当醛的苯环被萘基代替时, 亦可得到87%的产物(表 2, Entry 3);香豆素官能团也适用于此双消除反应(表 2, Entries 6, 7);三甲基硅基(Me3Si)乙炔基在反应条件下稳定, 相应Me3Si保护的芳香双炔烃(3i, 3j)亦可高产率地获得(表 2, Entries 8, 9);芳香杂环(噻吩和吡啶)取代的醛或砜也适用于此反应, 相应炔烃可高产率地得到(表 2, Entries 10, 11, 14, 15);而吲哚取代的醛或砜不能应用于此反应, 预期的吲哚类芳香炔烃不能通过此反应高产率地制备(表 2, Entries 12, 13, 16, 17), 此类反应有系列副产物生成, 这主要是由碱性条件下吲哚中仲胺与醛基发生缩合反应所导致的.上述研究结果表明:醛和砜芳环上取代基对反应无明显影响, 官能团化的非对称芳香炔烃可通过(PhO)2P(O)Cl促进芳香醛与砜缩合反应有效地制备.

Entry Ar1 Ar2 Product Yielda/% 1 

3b 90 2 3c 92 3 3d 87 4 3e 85 5 3f 83 6 3g 81 7 3h 78 8 3i 89 9 

3j 82 10 3k 80 11 3l 75 12 3m 2b 13 3n 3b 14 3o 82 15 3p 78 16 3m 3b 17 3n 4b aIsolated yields. bCrude 1H NMR yields. 我们研究了(PhO)2P(O)Cl促进的脂肪醛或砜缩合反应, 研究结果如表 3所示:脂肪醛或砜底物不适用于此缩合反应, 预期的目标产物未能较高产率地得到(Table 3, Entries 1~6).在芳香醛或砜的缩合反应中, 中间体氧负离子(Scheme 1, A)能与芳香环发生共轭离域而稳定.而在脂肪醛或砜的缩合反应中, 中间体氧负离子受到脂肪链的给电子诱导效应不稳定而难以生成.因此脂肪醛或砜的缩合反应不能高效地生成预期产物.

Entry R1 R2 Product Yielda/% 1 

3q 5 2 3r 3 3 3s 2 4 3t 3 5 3u 4 6 3v 2 aCrude 1H NMR yields. Ph2P(O)是端炔的一种理想保护基, 我们研究了其在(PhO)2P(O)Cl促进醛与砜缩合反应中的稳定性, 结果如Eq. 1所示:无论Ph2P(O)连接在醛或砜苯环的邻位, 间位还是对位, 对应Ph2P(O)保护的芳香双炔烃(3w, 3y, 3z)均可高效地获得; Ph2P(O)和Me3Si保护的芳香三炔烃(3x)亦可通过此缩合反应高效地制得.上述研究结果表明: Ph2P(O)在反应条件下稳定, Ph2P(O)保护的芳香多炔烃可通过缩合反应一锅高效合成.
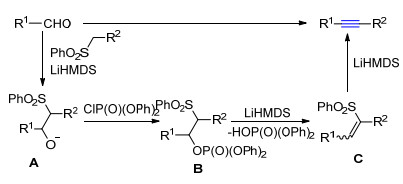
(PhO)2P(O)Cl促进的芳香醛与砜缩合反应机理如Scheme 1所示:在LiHMDS作用下, 醛与砜进行加成反应形成磺酰基取代的氧负离子A; A与(PhO)2P(O)Cl反应得到中间体膦酰基取代的砜类化合物B; 在LiHMDS作用下, B消去一分子磷酸二苯酯得到烯烃中间体C; 中间体C在LiHMDS作用下消去苯基亚磺酸得到乙炔衍生物.
(PhO)2P(O)Cl促进的芳香醛与砜缩合反应之所以能在室温下高效进行, 是因为(PhO)2P(O)Cl的反应活性比(EtO)2P(O)Cl低.在(PhO)2P(O)Cl中由于两个苯氧基(PhO)与磷氧双键P=O形成π-p-π大共轭体系π1618, 而在(EtO)2P(O)Cl分子中, 只有两个乙氧基(EtO)中的氧原子与磷氧双键P=O形成p-π共轭体系π46, 所以(PhO)2P(O)Cl中P原子的正电荷分散程度远比(EtO)2P(O)Cl中P原子正电荷分散程度大, 因此(PhO)2P(O)Cl反应活性比(EtO)2P(O)Cl小得多.由于(EtO)2P(O)Cl的高活泼性, 在室温的快速反应, 会导致系列副产物的形成.
红外光谱显示, 二元取代炔烃的特征红外特征频率一般在2100~2260 cm-1, 在3g、3h和3r新化合物红外光谱中均找到了炔键的特征频率, 由于3e具有较好的对称性, 其特征频率不明显.
2 结论
与氯磷酸二乙酯相比, 含有π1618共轭体系的氯磷酸二苯酯反应活性低且稳定性较好, 其促进的芳香醛与砜缩合反应可避免低温反应条件, 在室温下能有效进行, 可高产率地制备对应的非对称芳香炔烃.醛及砜芳环上取代基对反应无明显影响.官能团化的非对称芳香炔烃、噻吩及吡啶芳香炔烃、香豆素类芳香炔烃及二苯基膦酰基保护的芳香多炔烃可通过本缩合反应高效地制备, 具有操作简单、官能团耐受、产率高及反应条件温和等优点.
3 实验部分
3.1 仪器与试剂
实验过程中反应都是在氮气保护下进行的, 溶剂从中国医药集团上海试剂公司购买, 国产分析纯, 四氢呋喃经钠/二苯甲酮处理.试剂LiHMDS、(EtO)2P(O)Cl和(PhO)2P(O)Cl等从上海阿拉丁试剂公司购买.原料醛类化合物从中国医药集团上海试剂公司购买和上海沃凯化学试剂有限公司购买, 7-醛基香豆素和二苯基膦酰基苯基醛按文献方法[17, 18]合成得到.原料砜类化合物苄基苯基砜(2a)、1-甲氧基-4-[(苯磺酰基基)甲基]苯(2b)、1-碘-4-[(苯磺酰基基)甲基]苯(2c)、1-三甲基硅基乙炔基-4-[(苯磺酰基基)甲基]苯(2d)均按文献方法[14b]合成得到, 2-[(苯磺酰基基)甲基]噻吩(2e)、2-[(苯磺酰基基)甲基]噻吩吡啶(2f)均按文献方法[15]合成得到.其他原料的合成详见辅助材料.
1H NMR和13C NMR通过500 MHz超导核磁共振波谱仪(AV500 MHz, 德国布鲁克公司)测得, 其中化学位移以TMS作为内标; 红外光谱在红外光谱仪(Niclet 6700, 美国尼高力公司)测定; 高分辨率质谱(HRMS)通过电喷雾飞行时间质谱仪测得.
3.2 实验方法
室温, 在氮气保护下, 将LiHMDS (4.5 mmol, 1.0 mol/L的四氢呋喃(THF)溶液(4.5 mL)和(PhO)2P(O)Cl (0.2 mL, 1.2 mmol)慢慢加入到苯甲醛(1a)(106.1 mg, 1.0 mmol)和苄基苯基砜(2a)(278.8 mg, 1.2 mmol)的THF溶液中, 反应液在室温下搅拌12 h, 用饱和氯化铵溶液猝灭反应, 将反应液注入水中并用二氯甲烷(10 mL×3)萃取.有机相用饱和NaCl水溶液洗涤, 无水MgSO4干燥, 过滤后减压蒸去溶剂, 残余物通过硅胶柱层析分离(石油醚)得到167.5 mg 1, 2-二苯基乙炔(3a)[19], 产率为94%. 1H NMR (500 MHz, CDCl3) δ: 7.33~7.37 (m, 6H), 7.52~7.55 (m, 4H).
芳香炔烃3b~3n通过类似方法合成.
1-甲基-4-(苯乙炔基)苯(3b)[19]: 1H NMR (500 MHz, CDCl3) δ: 2.37 (s, 3H), 7.16 (d, J=7.9 Hz, 2H), 7.30~7.36 (m, 3H), 7.43 (d, J=7.9 Hz, 2H), 7.52~7.54 (m, 2H); 13C NMR (125 MHz, CDCl3) δ: 21.49, 88.68, 89.52, 120.10, 123.39, 128.05, 128.29, 129.09, 131.45, 131.50, 138.35.
1-甲氧基-4-(苯乙炔基)苯(3c)[19]: 1H NMR (500 MHz, CDCl3) δ: 3.83 (s, 3H), 6.88 (d, J=8.8 Hz, 2H), 7.29~7.36 (m, 3H), 7.46~7.48 (m, 2H), 7.50~7.52 (m, 2H); 13C NMR (125 MHz, CDCl3) δ: 55.26, 88.04, 89.34, 113.96, 115.34, 123.56, 127.92, 128.25, 131.42, 133.03, 159.58.
1-[(4-甲氧基苯基)乙炔基]萘(3d)[20]: 1H NMR (500 MHz, CDCl3) δ: 3.86 (s, 3H), 6.93 (d, J=8.8 Hz, 2H), 7.45 (t, J=7.3 Hz, 1H), 7.52~7.55 (m, 1H), 7.58~7.61 (m, 3H), 7.73~7.75 (m, 1H), 7.83 (d, J=8.2 Hz, 1H), 7.86 (d, J=7.9 Hz, 1H), 8.44 (d, J=8.2 Hz, 1H); 13C NMR (125 MHz, CDCl3) δ: 55.29 (d), 86.18, 94.33, 114.02, 115.44, 121.18, 125.27, 126.25, 126.34, 126.63, 128.25, 128.37, 130.02, 133.08, 133.16, 159.66.
1-氯-4-[(4-碘苯基)乙炔基]苯(3e):白色粉末. m.p. 128~130 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.24 (d, J=8.6 Hz, 2H), 7.33 (d, J=8.5 Hz, 2H), 7.45 (d, J=8.8 Hz, 2H), 7.70 (d, J=8.2 Hz, 2H); 13C NMR (125 MHz, CDCl3) δ: 89.34, 89.60, 94.40, 121.36, 122.40, 128.73, 132.76, 133.00, 134.53, 137.56; HRMS calcd for C14H8ClI: 337.9359, found 337.9365.
1-碘-4-[(4-甲氧基苯基)乙炔基]苯(3f)[16]: 1H NMR (300 MHz, CDCl3) δ: 3.83 (s, 3H), 6.88 (d, J=8.8 Hz, 2H), 7.23 (d, J=8.4 Hz, 2H), 7.46 (d, J=8.8 Hz, 2H), 7.67 (d, J=8.4 Hz, 2H).
7-(苯基乙炔基)香豆素(3g):浅黄色粉末. m.p. 146~148 ℃; 1H NMR (500 MHz, CDCl3) δ: 6.44 (d, J=10.0 Hz, 1H), 7.38~7.43 (m, 4H), 7.45~7.48 (m, 2H), 7.56~7.58 (m, 2H), 7.70 (d, J=10.0 Hz, 1H); 13C NMR (125 MHz, CDCl3) δ: 87.99, 92.92, 116.81, 118.60, 119.48, 122.30, 126.98, 127.65, 127.72, 128.46, 128.98, 131.77, 142.81, 153.75, 160.45; IR (KBr) v: 2207 cm-1; HRMS calcd for C17H10O2: 245.0681, found 245.0685.
7-[(4-甲氧基苯基)乙炔基]香豆素(3h):白色粉末. m.p. 158~159 ℃; 1H NMR (500 MHz, CDCl3) δ: 3.85 (s, 3H), 6.42 (d, J=10.0 Hz, 1H), 6.91 (d, J=10.0 Hz, 2H), 7.38~7.40 (m, 1H), 7.43~7.45 (m, 2H), 7.50 (d, J=5.0 Hz, 2H), 7.69 (d, J=10.0 Hz, 1H); 13C NMR (125 MHz, CDCl3) δ: 55.33, 86.97, 93.24, 114.12, 114.37, 116.59, 118.33, 119.24, 127.44, 127.49, 127.66, 133.34, 142.84, 153.82, 160.16, 160.53; IR (KBr) v: 2208 cm-1; HRMS calcd for C18H12O3: 276.0786, found 276.0789.
三甲基((4-(苯基乙炔基)苯基)乙炔基)硅烷(3i)[14b]:1H NMR (500 MHz, CDCl3) δ: 0.26 (s, 9H), 7.34~7.37 (m, 3H), 7.43~7.47 (m, 4H), 7.51~7.54 (m, 2H).
((4-((4-氯苯基)乙炔基)苯基)乙炔基)三甲基硅烷(3j):白色粉末. m.p. 122~124 ℃; 1H NMR (500 MHz, CDCl3) δ: 0.26 (s, 9H), 7.33 (d, J=8.6 Hz, 2H), 7.44~7.47 (m, 6H); 13C NMR (125 MHz, CDCl3) δ: -0.11 (d), 89.91, 90.08, 96.43, 104.49, 121.46, 122.91, 123.10, 128.71, 131.36, 131.91, 132.79, 134.48; IR (KBr) v: 2208 cm-1; HRMS calcd for C19H17ClSi: 308.0788, found 308.0795.
2-(苯基乙炔基)噻吩(3k)[21]: 1H NMR (500 MHz, CDCl3) δ: 7.01 (s, 1H), 7.28~7.34 (m, 5H), 7.52 (d, J=5.0 Hz, 2H).
2-(苯基乙炔基)吡啶(3l)[22]: 1H NMR (500 MHz, CDCl3) δ: 7.23~7.26 (m, 1H), 7.36~7.37 (m, 3H), 7.54 (d, J=5.0 Hz, 1H), 7.59~7.61 (m, 2H), 7.68 (t, J=7.5 Hz, 1H), 8.62 (d, J=5.0 Hz, 1H).
2-(p-甲苯基乙炔基)噻吩(3o)[23]: 1H NMR (500 MHz, CDCl3) δ: 2.37 (s, 3H), 7.00~7.02 (m, 1H), 7.16 (d, J=8.0 Hz, 2H), 7.26~7.28 (m, 2H), 7.41 (d, J=8.0 Hz, 2H).
2-[(4-甲氧基苯基)乙炔基]吡啶(3p)[16]: 1H NMR (500 MHz, CDCl3) δ: 3.83 (s, 3H), 6.89 (d, J=8.8 Hz, 2H), 7.20~7.23 (m, 1H), 7.50 (d, J=7.6 Hz, 1H), 7.55 (d, J=8.8 Hz, 2H), 7.65~7.68 (m, 1H), 8.61 (d, J=4.3 Hz, 1H).
((2-((2-溴苯基)乙炔基)苯基)乙炔基)二苯基氧化膦(3w)[16]: 1H NMR (500 MHz, CDCl3) δ: 7.17~7.20 (m, 2H), 7.28~7.30 (m, 1H), 7.33~7.39 (m, 5H), 7.44~7.48 (m, 3H), 7.58~7.60 (m, 1H), 7.64~7.67 (m, 2H), 7.90~7.95 (m, 4H); 13C NMR (75 MHz, CDCl3) δ: 86.33 (d, J=168.6 Hz), 91.19, 92.66, 103.37 (d, J=30.4 Hz), 122.15 (d, J=4.1 Hz), 124.55, 125.50, 126.39 (d, J=1.8 Hz), 126.94, 128.39, 128.44 (d, J=13.7 Hz), 129.78, 130.28, 130.85 (d, J=11.2 Hz), 132.04 (d, J=2.8 Hz), 132.28, 132.32, 133.00 (d, J=2.2 Hz), 132.79 (d, J=121.9 Hz), 133.55; 31P NMR (121 MHz, CDCl3) δ: 9.91.
二苯基((3-((4-((三甲基硅基)乙炔基)苯基)乙炔基)苯基)乙炔基)氧化膦(3x):白色粉末. m.p. 133~134 ℃; 1H NMR (500 MHz, CDCl3) δ: 0.26 (s, 9H), 7.38 (t, J=7.9 Hz, 1H), 7.45 (br, 4H), 7.49~7.53 (m, 4H), 7.55~7.59 (m, 4H), 7.75 (s, 1H), 7.88~7.92 (m, 4H); 13C NMR (125.65 MHz, CDCl3) δ: -0.13 (d, J=4.1 Hz), 83.58 (d, J=167.5 Hz), 89.52, 90.38, 96.60, 104.11 (d, J=29.5 Hz), 104.42, 120.41 (d, J=4.1 Hz), 122.59, 123.37, 123.81, 128.68 (d, J=13.4 Hz), 130.96 (d, J=11.3 Hz), 131.44, 131.92, 132.18, 132.32 (d, J=3.6 Hz), 132.82 (d, J=122.9 Hz), 133.57, 135.27; 31P NMR (121 MHz, CDCl3) δ: 9.85; IR (KBr) v: 2208 cm-1; HRMS calcd for C33H27OPSi: 498.1569, found 498.1573.
((3-((4-甲氧基苯基)乙炔基)苯基)乙炔基)二苯基氧化膦(3y)[8]: 1H NMR (500 MHz, CDCl3) δ: 3.84 (s, 3H), 6.89 (d, J=8.8 Hz, 2H), 7.36 (t, J=7.6 Hz, 1H), 7.47 (d, J=8.8 Hz, 2H), 7.49~7.54 (m, 5H), 7.56~7.58 (m, 3H), 7.74 (s, 1H), 7.88~7.93 (m, 4H); 13C NMR (125 MHz, CDCl3) δ: 55.28 (d, J=4.1 Hz), 83.27 (d, J=167.8 Hz), 86.48, 90.87, 104.36 (d, J=29.5 Hz), 114.02 (d, J=6.8 Hz), 114.58, 120.20 (d, J=4.1 Hz), 124.37, 128.66 (d, J=13.4 Hz), 130.93 (d, J=11.3 Hz), 131.63, 132.28, 132.30, 133.13 (d, J=4.2 Hz), 133.28, 133.43, 135.08, 159.86; 31P NMR (121 MHz, CDCl3) δ: 9.78.
(((4-((4-甲氧基苯基)乙炔基)苯基)乙炔基)二苯基氧化膦(3z)[16]: 1H NMR (500 MHz, CDCl3) δ: 3.84 (s, 3H), 6.89 (d, J=8.8 Hz, 2H), 7.46~7.53 (m, 8H), 7.56~7.57 (m, 4H), 7.88~7.93 (m, 4H); 13C NMR (75 MHz, CDCl3) δ: 55.25 (d, J=4.9 Hz), 84.25 (d, J=167.9 Hz), 87.36, 92.94, 104.94 (d, J=30.1 Hz), 114.04, 114.54, 118.88 (d, J=4.7 Hz), 126.15, 128.64 (d, J=13.4 Hz), 130.90 (d, J=10.8 Hz), 131.37, 132.26 (d, J=2.8 Hz), 132.36 (d, J=1.9 Hz), 132.83 (d, J=121.9 Hz), 133.16, 159.96; 31P NMR (121 MHz, CDCl3) δ: 9.78.
辅助材料(Supporting Information) 最终产物的1H NMR及部分13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Lu, W.; Haji, G. Z.; Aisa, A.; Cai, J. Tetrahedron Lett. 1998, 39, 9521. doi: 10.1016/S0040-4039(98)02212-6
-
[2]
Zhao, X.-G.; Ma, L.-C.; Zhang, L.; Wen, Y.-G.; Chen, J.-M.; Shuai, Z.-G.; Liu, Y.-Q.; Zhan, X.-W. Macromolecules 2013, 46, 2152. doi: 10.1021/ma302428x
-
[3]
Justin Thomas, K. R.; Kapoor, N.; Prasad Bolisetty, M. N. K.; Jou, J.-H.; Chen, Y.-L.; Jou, Y.-C. J. Org. Chem. 2012, 77, 3921. doi: 10.1021/jo300285v
-
[4]
Matsuo, D.; Yang, X.; Hamada, A.; Morimoto, K.; Kato, T.; Yahiro, M.; Adachi, C.; Orita, A.; Otera, J. Chem. Lett. 2010, 39, 1300. doi: 10.1246/cl.2010.1300
-
[5]
Yao, Z-Y.; Zhang, M.; Wu, H.; Yang, L.; Li, R-Z.; Wang, P. J. Am. Chem. Soc. 2015, 137, 3799. doi: 10.1021/jacs.5b01537
-
[6]
Fischer, M.; Lieser, G.; Rapp, A.; Schnell, I.; Mamdouh, W.; Feyter, S. D.; Schryver, F. C.; Höger, S. J. Am. Chem. Soc. 2004, 126, 214. doi: 10.1021/ja038484x
-
[7]
He, Z.-H.; Lai, G.-Q.; Li, Z.-F.; Yuan, X.; Shen, Y.-J.; Wang, C.-Y. Chin. J. Chem. 2015, 33, 550. doi: 10.1002/cjoc.201400870
-
[8]
Peng, L.-F.; Xu, F.; Suzuma, Y.; Orita, A.; Otera, J. J. Org. Chem. 2013, 78, 12802. doi: 10.1021/jo402176w
-
[9]
Yang, X.; Matsuo, D.; Suzuma, Y.; Fang, J.-K.; Xu, F.; Orita, A.; Otera, J.; Kajiyama, S.; Koumura, N.; Hara, K. Synlett 2011, 2402. doi: 10.1002/chin.201206078/full
-
[10]
Orita, A.; Hasegawa, D.; Nakano, T.; Otera, J. Chem.-Eur. J. 2002, 8, 2000. doi: 10.1002/1521-3765(20020503)8:9<2000::AID-CHEM2000>3.0.CO;2-B
-
[11]
关志朋, 师瑶, 石炜, 陈浩, 有机化学, 2017, 37, 418. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345754.shtmlGuan, Z. P.; Shi, Y.; Shi, W.; Chen, H. Chin. J. Org. Chem. 2017, 37, 418(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345754.shtml
-
[12]
王明明, 王子潇, 商明, 戴辉雄, 有机化学, 2015, 35, 570. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344813.shtmlWang, M. M.; Wang, Z. X.; Shang, M.; Dai, H. X. Chin. J. Org. Chem. 2015, 35, 570(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344813.shtml
-
[13]
Orita, A.; Otera, J. Chem. Rev. 2006, 106, 5387. doi: 10.1021/cr050560m
-
[14]
(a) Orita, A.; Yoshioka, N.; Struwe, P.; Braier, A.; Beckmann, A.; Otera, J. Chem.-Eur. J. 1999, 5, 1355.
(b) Orita, A.; Miyamoto, K.; Nakashima, M.; Ye, F.-G.; Otera, J. Adv. Synth. Catal. 2004, 346, 767. -
[15]
Orita, A.; Taniguchi, H.; Otera, J. Chem. Asian J. 2006, 1, 430. doi: 10.1002/(ISSN)1861-471X
-
[16]
Peng, L.-F.; Xu, F.; Shinohara, K.; Orita, A.; Otera, J. Org. Chem. Front. 2015, 2, 248. doi: 10.1039/C4QO00325J
-
[17]
Peng, L.-F.; Xu, F.; Shinohara, K.; Orita, A.; Otera, J. Chem. Lett. 2014, 43, 1610. doi: 10.1246/cl.140579
-
[18]
Iyengar, R. R.; Lynch, J. K.; Mulhern, M. M.; Judd, A. S.; Freeman, J. C.; Gao, J.; Souers, A. J.; Zhao, G.; Wodka, D.; Doug F., H.; Brodjian, S.; Dayton, B. D.; Reilly, R. M.; Swanson, S.; Su, Z.; Martin, R. L.; Leitza, S. T.; Houseman, K. A.; Diaz, G.; Collins, C. A.; Sham, H. L.; Kym, P. R. Bioorg. Med. Chem. Lett. 2007, 17, 874. doi: 10.1016/j.bmcl.2006.11.065
-
[19]
Jin, M.-J.; Lee, D.-H. Angew. Chem., Int. Ed. 2010, 49, 1119. doi: 10.1002/anie.v49:6
-
[20]
Li, X.; Yang, F.; Wu, Y.-J. J. Org. Chem. 2013, 78, 4543. doi: 10.1021/jo400574d
-
[1]
-
表 1 对比(EtO)2P(O)Cl和(PhO)2P(O)Cl促进的缩合反应a
Table 1. Comparison of (EtO)2P(O)Cl and (PhO)2P(O)Cl pro-moted condensation reaction

Entry ClP(O)X2 Solvent Temp./℃ Time/h Yieldb/% 1 ClP(O)(OEt)2 THF -78~r.t. 5 95 2 ClP(O)(OEt)2 THF r.t. 5 72 3 ClP(O)(OEt)2 CH2Cl2 r.t. 5 63 4 ClP(O)(OEt)2 THF r.t. 10 78 5 ClP(O)(OEt)2 DMF r.t. 5 72 6 ClP(O)(OPh)2 THF r.t. 5 86 7 ClP(O)(OPh)2 THF r.t. 10 92 8 ClP(O)(OPh)2 THF r.t. 12 94 aReaction conditions: benzaldehyde (1a) (1.0 mmol), (benzylsulfonyl)benzene (2a) (1.2 mmol), solvent (5.0 mL). bIsolated yields. 表 2 官能团化的芳香醛与砜缩合反应
Table 2. Condensation reaction of functionalized aldehydes and sulfones

Entry Ar1 Ar2 Product Yielda/% 1 

3b 90 2 3c 92 3 3d 87 4 3e 85 5 3f 83 6 3g 81 7 3h 78 8 3i 89 9 

3j 82 10 3k 80 11 3l 75 12 3m 2b 13 3n 3b 14 3o 82 15 3p 78 16 3m 3b 17 3n 4b aIsolated yields. bCrude 1H NMR yields. 表 3 脂肪醛或砜的缩合反应
Table 3. Condensation reaction of aliphatic aldehydes or sulfones

Entry R1 R2 Product Yielda/% 1 

3q 5 2 3r 3 3 3s 2 4 3t 3 5 3u 4 6 3v 2 aCrude 1H NMR yields. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 2347
- HTML全文浏览量: 167


 下载:
下载:
 下载:
下载:

