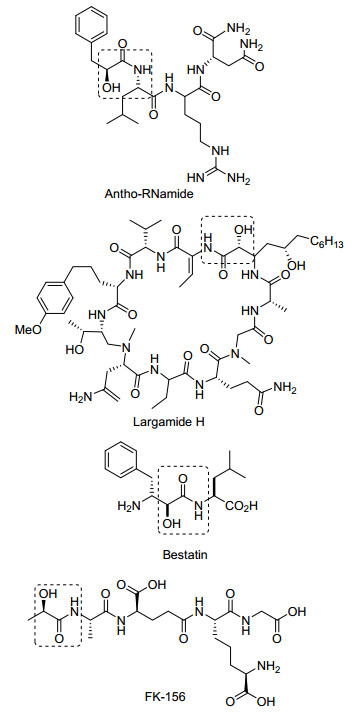
 图1
几种含α-羟基酰胺结构的药物
Figure1.
Drugs of α-hydroxyl amides
图1
几种含α-羟基酰胺结构的药物
Figure1.
Drugs of α-hydroxyl amides

Citation: Zhang Xinming, Guo Yujun, Tao Guide, Zhang Wu. Aerobic Oxidation for the Synthesis of N-Substituted α-Hydroxyl Phenylacetamides Promoted by Base[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2993-2999. doi: 10.6023/cjoc201704037

碱促进下空气氧化合成α-羟基苯乙酰胺
English
Aerobic Oxidation for the Synthesis of N-Substituted α-Hydroxyl Phenylacetamides Promoted by Base
-
Key words:
- α-hydroxyl amides
- / aerobic oxidation
- / synthesis
- / KOH-DMSO
-
α-羟基酰胺类化合物具有独特的药理和生理活性, 在有机化学和药物化学中占有重要的地位.一些含有α-羟基酰胺结构的化合物具有抗病毒、杀菌和抗肿瘤活性, 常被作为多种酶和抗体的抑制剂(图 1). α-羟基酰胺类化合物在有机合成领域也有重要应用, 可利用其来合成α-羰基酸[1]、α-羰基酰胺[2]、亚胺[3]以及环状化合物等[4].因而, 此类化合物的合成受到了越来越多的关注.文献中报道的α-羟基酰胺类化合物的合成方法主要有以下几种: α-羟基酰氯或α-羟基羧酸与胺反应[5], 过氧酸氧化酰胺类化合物[6], 通过α, β-不饱和酰胺合成α-羟基酰胺骨架[7], α-羟基乙腈与醇反应[8], 乙腈与醛反应[9], 氨甲酰基硅烷与醛反应等[10].现有的α-羟基酰胺类化合物的合成方法具有原料难以获得, 反应不易控制, 催化剂较为复杂或昂贵, 反应步骤较多, 常伴有副反应, 产率较低等缺点.因此, 寻求一种更为有效且温和的条件具有重要的研究意义.
空气是一种简单易得而又廉价无污染的绿色氧化剂, 自1938年利用空气氧化乙烯合成环氧乙烷的反应获得成功以后, 关于空气在有机合成上的应用研究一直方兴未艾[11].利用空气氧化饱和C—H合成羟基和羰基化合物也有相关报道[12]. 1999年, Ishskawa课题组[13]在铯盐作用下, 利用空气氧化1, 3-二羰基化合物的亚甲基得到羟基化合物. 2007年, 许斌课题组[14]在空气气氛下氧化酰胺的α-H合成α-羰基酰胺类化合物.这里我们报道一种利用空气氧化酰胺类化合物的α-H, 从而实现简单、高效地合成α-羟基酰胺类化合物的方法(Eq. 1).相比于已经报道的相关工作, 反应条件温和, 操作简便.
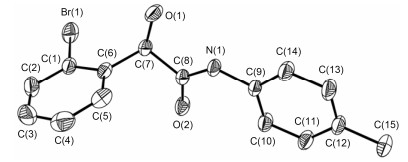
1 结果与讨论
我们用N-对甲苯基-2-(2-溴苯基)乙酰胺(1a)为反应物, 以KOH为碱, 二甲基亚砜(DMSO)为溶剂, 在不加任何催化剂和配体的条件下反应10 h后, 利用薄层色谱(TLC)跟踪, 发现反应体系中有一种新物质2a生成.分离提纯后, 对其进行核磁和质谱表征, 并进行了单晶结构解析, 确定所得产物是α-羟基酰胺类化合物(图 2).其晶体学数据存于英国剑桥数据中心, CCDC号为965258.接下来, 我们从氧化剂、碱、溶剂、反应温度和反应时间等方面进行条件优化, 结果见表 1.首先, 我们对溶剂进行了筛选(表 1, Entries 1~5), 发现常见的溶剂如甲苯、N, N-二甲基甲酰胺(DMF)、N-甲基-2-吡咯烷酮(NMP)、二氧六环中反应不能发生, KOH和二甲基亚砜(DMSO)的组合对反应最有效.通过查阅相关文献我们发现KOH-DMSO这种组合可以形成一种超强碱, 而可以对很多其他条件不易发生的反应有促进作用[15].其次, 我们对碱进行了筛选(表 1, Entries 6~11).当使用氢氧化钾、氢氧化钠、叔丁醇钾等作为碱时, 可以促进反应的发生, 其中氢氧化钾效果最好.而碳酸钾、碳酸钠、磷酸钾等均不能促进反应的进行.我们进一步考察了碱的用量对反应的影响, 当分别加入相当于反应物酰胺的1.0、1.5、2.0、2.5和3.0 equiv.的KOH时, 得到产率分别是45%, 60%, 70%, 71%, 73%.出于对反应成本及其他各方面因素的考虑, 确定反应中加入碱的量为2.0 equiv.最后, 我们对反应温度和时间进行了优化(表 1, Entries 12~19), 发现室温时, 不利于反应的进行, 当温度升高到100 ℃时, 反应变得复杂, 产率明显降低.当反应时间为18 h, 产率只有45%.因此, 选定反应时间为24 h, 反应温度为50 ℃.

Entry Base Solvent Temp./℃ Time/h Yieldb/% 1 KOH (2.0 equiv.) DMSO 50 24 70 2 KOH (2.0 equiv.) Diglyme 50 24 63 3 KOH (2.0 equiv.) Toluene 50 24 Trace 4 KOH (2.0 equiv.) NMP 50 24 Trace 5 KOH (2.0 equiv.) DMF 50 24 Trace 6 NaOH (2.0 equiv.) DMSO 50 24 10 7 KOtBu (2.0 equiv.) DMSO 50 24 35 8 K2CO3 (2.0 equiv.) DMSO 50 24 Trace 9 KOH (1.0 equiv.) DMSO 50 24 45 10 KOH (1.5equiv.) DMSO 50 24 60 11 KOH (3.0equiv.) DMSO 50 24 73 12 KOH (2.0 equiv.) DMSO r.t. 24 42 13 KOH (2.0 equiv.) DMSO 40 24 60 14 KOH (2.0 equiv.) DMSO 70 24 72 15 KOH (2.0 equiv.) DMSO 100 24 30 16 KOH (2.0 equiv.) DMSO 50 12 10 17 KOH (2.0 equiv.) DMSO 50 18 45 18 KOH (2.0 equiv.) DMSO 50 30 73 19 KOH (2.0 equiv.) DMSO 50 48 78 20c KOH (2.0 equiv.) DMSO 50 12 98 aReaction conditions: amides 1a (0.5 mmol), KOH (1 mmol), solvent (2 mL), stirred at 50 ℃ under argon for 24 h. bIsolated yields. cIn air sealed tube. 对于反应中DMSO是否起到氧化作用及氧气是否是真正的氧化剂[16], 我们进行了系列研究.首先用新蒸的DMSO在氩气保护下重复了以上实验, 发现几乎没有产物生成, 表明KOH/DMSO不能氧化此类反应.我们推测是DMSO中残留的少量氧气在此条件下起到了氧化的作用.于是, 我们将反应条件改为在空气气氛中封管进行, 发现原料几乎百分百转化, 而且反应专一性较强(表 1, Entry 20).
在最优的反应条件下, 我们对底物进行了拓展, 探索了不同取代基对酰胺氧化反应的影响, 得到了相应的21个α-羟基酰胺类产物, 反应结果见表 2.从表中可以看出酰胺的取代基R1, R2不同时, 反应产率有较大差异.总的说来, 含供电子取代基的酰胺产率要高于含吸电子取代基的酰胺; 取代基的位阻对产率影响也非常大, 当取代基处于对位时, 其产率要远高于其处于邻位; 另外亚甲基的反应活性要优于次甲基.

Entry 2 Yieldb/% 1 
98 2 
97 3 
97 4 
88 5 
98 6 
80 7 
95 8 
68 9 
66 10 
60 11 
72 12 
90 13 
84 14 
82 15 
75 16 
78 17 
86 18 
99 19c 
97 20c 
96 21c 
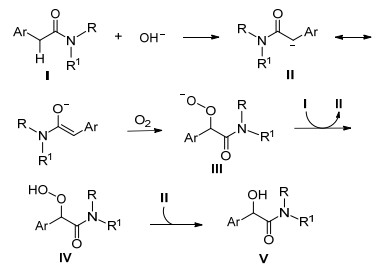
93 aReaction conditions: amides (0.5 mmol), KOH (1 mmol), stirred in DMSO (2 mL) in air sealed tube at 50 ℃ for 24 h. bIsolated yield. cReaction conditions for methine-aryl amides: amides (0.5 mmol), KOH (1 mmol), DMSO (2 mL) stirred under oxygen at 80 ℃ for 24 h. 我们对反应机理进行了初步的研究.在反应体系中加入1 equiv.自由基抑制剂2, 2, 6, 6-四甲基哌啶-1-氧自由基(TEMPO), 只得到了痕量的目标产物.加入2 equiv. TEMPO, 主要生成羰基化产物.当加入2 equiv. 2, 6-二叔丁基-4-甲基苯酚(BHT), 对反应几乎没影响.通过以上的实验结果结合前人的文献报道[16], 我们提出了如Scheme 1所示反应机理.苯乙酰胺类化合物Ⅰ在碱的作用下, 首先形成烯醇负离子中间体Ⅱ, 中间体Ⅱ与空气中氧气作用形成过氧负离子中间体Ⅲ, 中间体Ⅲ和原料苯乙酰胺类化合物Ⅰ发生质子交换反应后, 中间体Ⅲ转化成过氧化物中间体Ⅳ, 而苯乙酰胺类化合物Ⅰ转化为中间体Ⅱ, 最终形成目标产物Ⅴ.
2 结论
针对文献中的有关制备α-羟基酰胺存在的不足, 首次以酰胺为原料, 在温和条件下利用空气为氧化剂氧化制得α-羟基酰胺类化合物.与其他合成α-羟基酰胺类化合物方法相比较, 该体系有如下优点:所用的原料简单易得, 反应条件温和, 无需高昂的氧化剂和配体等, 反应体系简单, 易于后处理, 且有效降低了成本.因此, 我们所发展的碱促进的空气氧化合成α-羟基酰胺产物对于工业生产具有很好的参考价值.
3 实验部分
3.1 仪器与试剂
核磁共振氢谱和碳谱(1H NMR和13C NMR)由Bruker公司的AV-300/500型核磁共振仪(300 MHz/75 MHz)测定; 以TMS (δ=0)作内标; 高分辨率质谱(HRMS)由Agilent 6200 LC/MS TOF液相色谱-飞行时间质谱联用仪测定; 熔点由X-4显微熔点测定仪测定, 未经校正.
苯乙酰胺参考文献[18]制备.其他反应试剂均在购买后直接使用.
3.2 实验方法
取一个干燥的二颈瓶, 加入0.5 mmol酰胺和1 mmol氢氧化钾以及2 mL DMSO, 在空气气氛中封管, 对反应瓶油浴加热.待反应结束后冷却到室温, 用乙酸乙酯萃取, 无水硫酸镁干燥, 过滤, 旋干后用柱层析分离提纯得到产物2.
N-对甲苯基-2-(2-溴苯基)-2-羟基乙酰胺(2a):白色固体, 产率98%. m.p. 148~149 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.07 (s, 1H), 7.60 (d, J=7.8 Hz, 1H), 7.49 (d, J=7.5 Hz, 1H), 7.41~7.33 (m, 3H), 7.21 (t, J=7.5 Hz, 1H), 7.12 (d, J=7.8 Hz, 2H), 5.62 (d, J=3.6 Hz, 1H), 4.08 (d, J=3.3 Hz, 1H), 2.31 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 169.3, 138.7, 134.6, 134.4, 133.1, 130.3, 129.6, 128.9, 128.4, 123.0, 119.9, 72.7, 20.9. HRMS (ESI) calcd for C15H15BrNO2 ([M+H]+) 320.0286, found 320.0285.
N-苯基-2-(2-溴苯基)-2-羟基乙酰胺(2b):白色固体, 产率97%. m.p. 140~141 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.12 (s, 1H), 7.61 (d, J=7.8 Hz, 1H), 7.54~7.50 (m, 3H), 7.39~7.30 (m, 3H), 7.21 (d, J=7.2 Hz, 1H), 7.13 (t, J=7.5 Hz, 1H), 5.65 (s, 1H), 4.01 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 169.5, 138.6, 137.0, 133.1, 130.3, 129.1, 128.9, 128.3, 124.9, 123.1, 119.9, 72.9. HRMS (ESI) calcd for C14H13BrNO2 ([M+H]+) 306.0129, found 306.0129.
N-对氯苯基-2-(2-溴苯基)-2-羟基乙酰胺(2c):白色固体, 产率97%. m.p. 134~135 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.19 (s, 1H), 7.61 (d, J=7.8 Hz, 1H), 7.49 (d, J=8.1 Hz, 3H), 7.37 (t, J=7.5 Hz, 1H), 7.29 (d, J=8.7 Hz, 2H), 7.22 (d, J=7.5Hz, 1H), 5.65 (d, J=3.6 Hz, 1H), 3.86 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 169.4, 138.4, 135.6, 133.2, 130.4, 129.9, 129.1, 128.9, 128.4, 123.0, 121.1, 73.0. HRMS (ESI) calcd for C14H12BrClNO2 ([M+H]+) 339.9740, found 339.9740.
N-邻甲苯基-2-(2-溴苯基)-2-羟基乙酰胺(2d): 1H NMR (300 MHz, CDCl3) δ: 9.54 (s, 1H), 9.10 (m, 4H), 8.75 (m, 4H), 7.31 (d, J=3.7 Hz, 1H), 5.95 (d, J=4.1 Hz, 1H), 3.78 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 169.65, 133.04, 130.55, 130.41, 128.76, 128.44, 126.91, 125.41, 122.18, 72.63, 17.65. HRMS (ESI) calcd for C15H15BrNO2 ([M+H]+) 320.0286, found 320.0286.
N-(4-乙氧基苯基)-2-(2-溴苯基)-2-羟基乙酰胺(2e):白色固体, 产率98%. m.p. 103~104 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.03 (s, 1H), 7.59 (d, J=7.8 Hz, 1H), 7.48 (d, J=7.5 Hz, 1H), 7.37 (m, 3H), 7.20 (t, J=7.5 Hz, 1H), 6.84 (d, J=8.4 Hz, 2H), 5.61 (d, J=3.0 Hz, 1H), 4.11 (d, J=3.6 Hz, 1H), 4.00 (q, J=6.6 Hz, 2H), 1.39 (t, J=6.9 Hz, 3H); 13C NMR (75 MHz, CDCl3) δ: 169.2, 156.2, 138.8, 133.1, 130.3, 130.0, 128.9, 128.4, 123.0, 121.7, 114.9, 72.8, 63.8, 14.8. HRMS (ESI) calcd for C16H17BrNO3 ([M+H]+) 350.0392, found 350.0391.
N-(4-三氟甲基苯基)-2-(2-溴苯基)-2-羟基乙酰胺(2f):白色固体, 产率80%. m.p. 189~191 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 7.86 (d, J=8.1 Hz, 2H), 7.62 (d, J=7.2 Hz, 3H), 7.54 (d, J=7.8 Hz, 1H), 7.37 (t, J=7.5 Hz, 1H), 7.23 (t, J=7.2 Hz, 1H), 5.65 (s, 1H), 3.31 (s, 1H); 13C NMR (75 MHz, MeOD) δ: 170.1, 139.6, 138.0, 131.1, 128.0, 127.3, 125.9, 124.2 (q, J=15.6 Hz), 124.1 (q, J=3.8 Hz), 122.0, 118.4, 71.9. HRMS (ESI) calcd for C15H12BrF3NO2 ([M+H]+) 374.0003, found 374.0002.
N, N-二苯基-2-(2-溴苯基)-2-羟基乙酰胺(2g):白色固体, 产率95%. m.p. 120~122 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.59 (s, 1H), 7.62 (d, J=7.2 Hz, 3H), 7.50 (d, J=6.9 Hz, 1H), 7.34~7.27 (m, 6H), 7.22~7.15 (m, 2H), 7.01 (d, J=7.5 Hz, 3H), 6.16 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 166.5, 156.3, 137.0, 136.1, 133.4, 130.4, 129.9, 129.1, 128.4, 128.0, 124.9, 124.6, 122.7, 120.0, 116.0, 79.0. HRMS (ESI) calcd for C20H17BrNO2 ([M+H]+) 382.0443, found 382.0442.
N-对甲苯基-2-苯基-2-羟基乙酰胺(2h):白色固体, 产率68%. m.p. 172~173 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.00 (s, 1H), 7.49~7.38 (m, 7H), 7.11 (d, J=7.8 Hz, 2H), 5.18 (d, J=3.0 Hz, 1H), 3.43 (d, J=3.0 Hz, 1H), 2.31 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 169.7, 139.1, 134.5, 134.4, 129.5, 129.0, 128.9, 126.9, 119.8, 74.7, 20.8. HRMS (ESI) calcd for C15H16NO2 ([M+H]+) 284.1181, found 284.1181.
N, 2-二苯基-2-羟基乙酰胺(2i):白色固体, 产率66%. m.p. 147~148 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.20 (s, 1H), 7.52~7.46 (m, 4H), 7.39~7.29 (m, 5H), 7.13 (t, J=6.9 Hz, 1H), 5.15 (s, 1H), 3.58 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 170.0, 139.0, 137.1, 129.0, 129.0, 128.9, 126.9, 124.7, 119.8, 74.7. HRMS (ESI) calcd for C14H14NO2 ([M+H]+) 228.1024, found 228.1024.
N-(4-三氟甲基苯基)-2-苯基-2-羟基乙酰胺(2j):白色固体, 产率60%. m.p. 206~208 ℃; 1H NMR (300 MHz, CD3OD) δ: 7.83 (d, J=8.1 Hz, 2H), 7.60 (d, J=7.8 Hz, 2H), 7.54 (d, J=6.6 Hz, 2H), 7.35 (d, J=8.1 Hz, 3H), 5.17 (s, 1H), 3.31 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 172.7, 141.3, 139.9, 128.1, 127.9, 126.5, 125.7, 125.6 (q, J=3.8 Hz), 119.9, 74.4; HRMS (ESI) calcd for C15H13F3-NO2 ([M+H]+) 296.0898, found 296.0898.
N-(4-甲氧基苯基)-2-苯基-2-羟基乙酰胺(2k):白色固体, 产率72%. m.p. 146~148 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.06 (s, 1H), 7.55~7.44 (m, 7H), 7.32 (s, 1H), 6.90 (d, J=8.7 Hz, 2H), 5.23 (s, 1H), 3.84 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 169.7, 156.7, 139.1, 130.2, 129.0, 128.9, 127.0, 121.5, 114.2, 74.6, 55.5. HRMS (ESI) calcd for C15H16NO3 ([M+H]+) 258.1130, found 258.1125.
N, 2-二(对甲基苯基)-2-羟基乙酰胺(2l):白色固体, 产率90%. m.p. 143~144 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.11 (s, 1H), 7.37 (d, J=8.1 Hz, 2H), 7.32 (d, J=7.8 Hz, 2H), 7.18 (d, J=7.8 Hz, 2H), 7.10 (d, J=8.1 Hz, 2H), 5.07 (s, 1H), 3.54 (s, 1H), 2.34 (s, 3H), 2.30 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 170.1, 138.7, 136.2, 134.5, 134.3, 129.6, 129.5, 126.8, 119.9, 74.4, 21.2, 20.9. HRMS (ESI) calcd for C16H18NO2 ([M+H]+) 256.1337, found 256.1336.
N-苯基-2-对甲苯基-2-羟基乙酰胺(2m):白色固体, 产率84%. m.p. 125~126 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.22 (s, 1H), 7.50 (d, J=7.8 Hz, 2H), 7.33~7.31 (m, 4H), 7.17 (d, J=7.5 Hz, 2H), 7.13~7.08 (m, 1H), 5.08 (s, 1H), 3.65 (s, 1H), 2.33 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 170.3, 138.7, 137.1, 136.1, 129.6, 129.0, 126.8, 124.6, 119.8, 74.5, 21.2. HRMS (ESI) calcd for C15H16NO2 ([M+H]+) 242.1181, found 242.1181.
N-(4-氯苯基)-2-对甲苯基-2-羟基乙酰胺(2n):白色固体, 产率82%. m.p. 147~149 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.23 (s, 1H), 7.47 (d, J=8.7 Hz, 2H), 7.33 (d, J=7.5 Hz, 2H), 7.26 (d, J=8.4 Hz, 2H), 7.19 (d, J=7.8 Hz, 2H), 5.13 (s, 1H), 3.33 (s, 1H), 2.35 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 170.1, 139.0, 135.8, 135.7, 129.7, 129.0, 126.8, 121.0, 74.6, 21.1. HRMS (ESI) calcd for C15H15ClNO2 ([M+H]+) 276.0791, found 276.0792.
N-(4-三氟甲基苯基)-2-对甲苯基-2-羟基乙酰胺(2o):白色固体, 产率75%. m.p. 190~191 ℃; 1H NMR (300 MHz, CD3OD) δ: 7.82 (d, J=8.1 Hz, 2H), 7.59 (d, J=7.8 Hz, 2H), 7.40 (d, J=7.2 Hz, 2H), 7.18 (d, J=7.2 Hz, 2H), 5.13 (s, 1H), 3.31 (s, 1H), 2.32 (s, 3H); 13C NMR (75 MHz, CD3OD) δ: 172.8, 141.3, 137.8, 136.9, 128.7, 126.5, 125.6(q, J=3.8 Hz), 125.5, 119.8, 74.3, 19.8; HRMS (ESI) calcd for C16H15F3NO2([M+H]+) 310.1055, found 310.1055.
N-苯基-2-对氯苯基-2-羟基乙酰胺(2p):白色固体, 产率78%. m.p. 119~120 ℃; 1H NMR ((300 MHz, CD3OD) δ: 7.49~7.41 (m, 4H), 7.28~7.18 (m, 4H), 7.03~7.01 (m, 1H), 5.05 (s, 1H), 3.21 (s, 1H); 13C NMR (75 MHz, CD3OD) δ: 173.2, 140.4, 138.9, 134.9, 131.8, 131.7, 129.8, 129.5, 125.7, 121.7, 75.0. HRMS (ESI) calcd for C14H13ClNO2 ([M+H]+) 262.0635, found 262.0628.
N-苯基-2-对甲氧基苯基-2-羟基乙酰胺(2q):白色固体, 产率86%. m.p. 101~102 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.87 (s, 1H), 7.69 (d, J=7.2 Hz, 2H), 7.41 (d, J=7.8 Hz, 2H), 7.31~7.26 (m, 2H), 7.05 (d, J=6.9 Hz, 2H), 6.31 (d, J=3.9 Hz, 1H), 5.04 (d, J=3.9 Hz, 1H), 3.73 (s, 3H); 13C NMR (75 MHz, d6-DMSO) δ: 171.9, 159.3, 139.1, 133.4, 128.3, 124.0, 120.1, 114.0, 74.0, 55.5. HRMS (ESI) calcd for C15H16NO3 ([M+H]+) 258.1130, found 258.1134.
N-对甲基苯基-2, 2-二苯基-2-羟基乙酰胺(2r):白色固体, 产率99%. m.p. 191~193 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.42 (s, 1H), 7.50~7.38 (m, 12H), 7.15 (d, J=7.8 Hz, 2H), 3.72 (s, 1H), 2.34 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 170.9, 142.7, 134.6, 134.4, 129.5, 128.4, 128.3, 127.6, 119.8, 81.9, 20.9; HRMS (ESI) calcd for C21H18NO ([M-H2O+H]+) 300.1388, found 300.1390.
N, 2, 2-三苯基-2-羟基乙酰胺(2s):白色固体, 产率97%. m.p. 175~177 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.53 (s, 1H), 7.60~7.51 (m, 6H), 7.40~7.32 (m, 8H), 7.15 (t, J=7.2 Hz, 1H), 3.65 (s, 1H); 13C NMR (75 MHz, CDCl3) δ: 171.0, 142.6, 137.2, 129.1, 128.5, 128.4, 127.6, 124.8, 119.7, 81.9. HRMS (ESI) calcd for C20H16NO ([M-H2O+H]+) 286.1232, found 286.1233.
N-对甲基苯基-2-苯基-2-羟基丁酰胺(2t):白色固体, 产率96%. m.p. 122~123 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.56 (s, 1H), 7.66 (d, J=7.2 Hz, 2H), 7.43~7.31 (m, 5H), 7.11 (d, J=7.8 Hz, 2H), 3.20 (s, 1H), 2.49~2.37 (m, 1H), 2.32 (s, 3H), 2.20~2.08 (m, 1H), 0.98 (t, J=7.2 Hz, 3H); 13C NMR (75 MHz, CDCl3) δ: 171.9, 142.2, 134.8, 134.0, 129.4, 128.4, 127.8, 125.5, 119.8, 79.7, 32.3, 20.9, 7.9. HRMS (ESI) calcd for C17H18NO ([M-H2O+H]+) 252.1388, found 252.1383.
N, 2-二苯基-2-羟基丁酰胺(2u):白色固体, 产率93%. m.p. 85~87 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.59 (s, 1H), 7.67 (d, J=7.2 Hz, 2H), 7.55 (d, J=7.5 Hz, 2H), 7.40~7.29 (m, 5H), 7.11 (t, J=7.2 Hz, 1H), 2.96 (s, 1H), 2.52~2.40 (m, 1H), 2.23~2.11 (m, 1H), 1.00 (t, J=7.2 Hz, 3H); 13C NMR (75 MHz, CDCl3) δ: 171.7, 141.9, 137.4, 129.0, 128.5, 128.0, 125.4, 124.4, 119.7, 79.8, 32.4, 7.9; HRMS (ESI) calcd for C16H18NO2 ([M+H]+) 256.1337, found 256.1332.
辅助材料(Supporting Information) 目标产物1H NMR和13C NMR的谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Pansare, S. V.; Ravi, R. G.; Jain, R. P. J. Org. Chem. 1998, 63, 4120. doi: 10.1021/jo9722820
-
[2]
Chen, C. T.; Bettigeri, S.; Weng, S. S.; Pawar, V. D.; Lin, Y. H.; Liu, C. Y.; Lee, W. Z. J. Org. Chem. 2007, 72, 8175. doi: 10.1021/jo070575f
-
[3]
Szymanski, W.; Westerbeek, A.; Janssen, D, B.; Feringa, B, L. Angew. Chem., Int. Ed. 2011, 50, 10712. doi: 10.1002/anie.201105164
-
[4]
Zhang, M.; Imm, S.; Bahn, S.; Neumann, H.; Beller, M. Angew. Chem., Int. Ed. 2011, 50, 11197. doi: 10.1002/anie.v50.47
-
[5]
Katritzky, A. R.; Singh, S. K.; Cai, C.; Bobrov, S. J. Org. Chem. 2006, 71, 3364. doi: 10.1021/jo052293q
-
[6]
Pailloux, S.; Binyamin, I.; Deck, L. M.; Rapko, B. M.; Hay, B. P.; Duesler, E. N.; Paine, R. T. J. Org. Chem. 2007, 72, 9195. doi: 10.1021/jo701408y
-
[7]
Nemoto, T.; Kakei, H.; Gnanadesikan, V.; Tosaki, S.; Ohshima, T.; Shibasaki, M. J. Am. Chem. Soc. 2002, 124, 14544. doi: 10.1021/ja028454e
-
[8]
Kikugawa, Y.; Matsumoto, K.; Mitsui, K. J. Chem. Soc., Chem. Commun. 1992, 12, 921.
-
[9]
Denmark, S. E.; Fan, Y. J. Org. Chem. 2005, 70, 9667. doi: 10.1021/jo050549m
-
[10]
姚远, 李伟东, 仝文婷, 陈建新, 有机化学, 2015, 35, 223. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344630.shtmlYao, Y.; Li, W. D.; Tong, W. T.; Chen, J. X. Chin. J. Org. Chem. 2015, 35, 223(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344630.shtml
-
[11]
(a) Stahl, S. S. Angew. Chem., Int. Ed. 2004, 43, 3400.
(b) Wendlandt, A. E.; Suess, A. M.; Stahl, S. S. Angew. Chem., Int. Ed. 2011, 50, 11062. -
[12]
(a) Gassman, P. G.; Halweg, K. M. J. Org. Chem. 1979, 44, 628.
(b) Sereda, G.; Rajpara, V. Tetrahedron Lett. 2007, 48, 3417.
(c) Hamano, M.; Nagy, K. D.; Jensen, K. F. Chem. Commun. 2012, 48, 2086.
(d) Zheng, G.; Liu, H.; Wang, M. Chin. J. Chem. 2016, 34, 519.
(e) Zhang, J.; Jiang, Z. Q.; Zhao, D.; He, G. Z.; Zhou, S. L.; Han, S. Q. Chin. J. Chem. 2013, 31, 794. -
[13]
Watanabe, T.; Ishikawa, T. Tetrahedron Lett. 1999, 40, 7795. doi: 10.1016/S0040-4039(99)01618-4
-
[14]
Song, B. G.; Wang, S. Y.; Sun, C. Y.; Deng, H. M.; Xu, B. Tetrahedron Lett. 2007, 48, 8982. doi: 10.1016/j.tetlet.2007.10.099
-
[15]
(a) Trofimov, B. A.; Malysheva, S. F.; Gusarova, N. K.; Kuimov, V. A.; Belogorlova, N. A.; Sukhov, B. G. Tetrahedron Lett. 2008, 49, 3480.
(b) Duan, Z. G.; Ranjit, S.; Liu, X. G. Org. Lett. 2010, 12, 2430.
(c) Yuan, Y.; Thome, I.; Kim, S. H.; Chen, D.; Beyer, A.; Bonnamour, J.; Zuidema, E.; Chang, S.; Bolm, C. Adv. Synth. Catal. 2010, 352, 2892.
(d) Beyer, A.; Reucher, C. M. M.; Bolm, C. Org. Lett. 2011, 13, 2876. -
[16]
(a) Lipton, S. H.; Bodwell, C. E. J. Agric. Food Chem. 1976, 24, 26.
(b) Gogoi, P.; Sarmah, G. K.; Konwar, D. J. Org. Chem. 2004, 69, 5153.
(c) Le, H. V.; Ganem, B. Org. Lett, 2011, 13, 2584.
(d) Chaudhari, M. B.; Sutar, Y.; Malpathak, S.; Hazra, A.; Gnanaprakasam, B. Org. Lett. 2017, 19, 3628. -
[17]
(a) Avramoff, M.; Sprinzak, Y. J. Am. Chem. Soc. 1963, 85, 1655.
(b) Wasserman, H. H.; Lipahutz, B. H. Tetrahedron Lett. 1975, 16, 1731. -
[18]
Sun, J.; Liu, B. X.; Xu, B. RSC Adv. 2013, 3, 5824. doi: 10.1039/c3ra40657a
-
[1]
-
表 1 对反应条件的优化a
Table 1. Optimization of the aerobic oxidation reaction

Entry Base Solvent Temp./℃ Time/h Yieldb/% 1 KOH (2.0 equiv.) DMSO 50 24 70 2 KOH (2.0 equiv.) Diglyme 50 24 63 3 KOH (2.0 equiv.) Toluene 50 24 Trace 4 KOH (2.0 equiv.) NMP 50 24 Trace 5 KOH (2.0 equiv.) DMF 50 24 Trace 6 NaOH (2.0 equiv.) DMSO 50 24 10 7 KOtBu (2.0 equiv.) DMSO 50 24 35 8 K2CO3 (2.0 equiv.) DMSO 50 24 Trace 9 KOH (1.0 equiv.) DMSO 50 24 45 10 KOH (1.5equiv.) DMSO 50 24 60 11 KOH (3.0equiv.) DMSO 50 24 73 12 KOH (2.0 equiv.) DMSO r.t. 24 42 13 KOH (2.0 equiv.) DMSO 40 24 60 14 KOH (2.0 equiv.) DMSO 70 24 72 15 KOH (2.0 equiv.) DMSO 100 24 30 16 KOH (2.0 equiv.) DMSO 50 12 10 17 KOH (2.0 equiv.) DMSO 50 18 45 18 KOH (2.0 equiv.) DMSO 50 30 73 19 KOH (2.0 equiv.) DMSO 50 48 78 20c KOH (2.0 equiv.) DMSO 50 12 98 aReaction conditions: amides 1a (0.5 mmol), KOH (1 mmol), solvent (2 mL), stirred at 50 ℃ under argon for 24 h. bIsolated yields. cIn air sealed tube. 表 2 空气氧化酰胺反应的底物拓展a
Table 2. Scope of the aerobic oxidation for the synthesis of α-hydroxyl amides

Entry 2 Yieldb/% 1 
98 2 
97 3 
97 4 
88 5 
98 6 
80 7 
95 8 
68 9 
66 10 
60 11 
72 12 
90 13 
84 14 
82 15 
75 16 
78 17 
86 18 
99 19c 
97 20c 
96 21c 
93 aReaction conditions: amides (0.5 mmol), KOH (1 mmol), stirred in DMSO (2 mL) in air sealed tube at 50 ℃ for 24 h. bIsolated yield. cReaction conditions for methine-aryl amides: amides (0.5 mmol), KOH (1 mmol), DMSO (2 mL) stirred under oxygen at 80 ℃ for 24 h. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1366
- HTML全文浏览量: 89


 下载:
下载:


 下载:
下载:

