
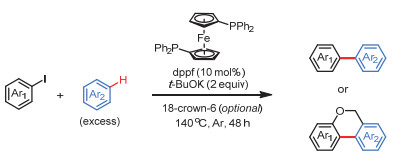
1, 1'-双(二苯基膦基)二茂铁介导的芳烃碳氢键芳基化反应制备联芳基骨架
-
关键词:
- 碳氢键芳基化
- / 叔丁醇钾
- / 1, 1'-双(二苯基膦)二茂铁
- / 自由基
- / 联芳基合成
English
DPPF-Mediated C―H Arylation of Arenes with Aryl Iodides for Synthesis of Biaryl Linkages
-
Key words:
- C―H arylation
- / tert-butoxide
- / DPPF
- / Radical
- / Biaryl synthesis
-
-
[1]
Bringmann, G.; Walter, R.; Weirich, R. Angew. Chem. Int. Edit. 1990, 29, 977. doi: 10.1002/anie.199009771
-
[2]
Zhang, Y. -F.; Shi, Z. -J. Acc. Chem. Res. 2018, 52, 161. doi: 10.1021/acs.accounts.8b00408
-
[3]
Lei, A.; Liu, W.; Liu, C.; Chen, M. Dalton Trans. 2010, 39, 10352. doi: 10.1039/c0dt00486c
-
[4]
Ackermann, L.; Vicente, R.; Kapdi, A. R. Angew. Chem. Int. Edit. 2009, 48, 9792. doi: 10.1002/anie.200902996
-
[5]
Bolton, R.; Williams, G. H. Chem. Soc. Rev. 1986, 15, 261. doi: 10.1039/cs9861500261
-
[6]
Bowman, W. R.; Storey, J. M. Chem. Soc. Rev. 2007, 36, 1803. doi: 10.1039/b605183a
-
[7]
Yanagisawa, S.; Ueda, K.; Taniguchi, T.; Itami, K. Org. Lett. 2008, 10, 4673. doi: 10.1021/ol8019764
-
[8]
Liu, W.; Cao, H.; Zhang, H.; Zhang, H.; Chung, K. H.; He, C.; Wang, H.; Kwong, F. Y.; Lei, A. J. Am. Chem. Soc. 2010, 132, 16737. doi: 10.1021/ja103050x
-
[9]
Sun, C. -L.; Li, H.; Yu, D. -G.; Yu, M.; Zhou, X.; Lu, X. -Y.; Huang, K.; Zheng, S. -F.; Li, B. -J.; Shi, Z. -J. Nat. Chem. 2010, 2, 1044. doi: 10.1038/NCHEM.862
-
[10]
Shirakawa, E.; Itoh, K. -I.; Higashino, T.; Hayashi, T. J. Am. Chem. Soc. 2010, 132, 15537. doi: 10.1021/ja1080822
-
[11]
Leadbeater, N. E. Nat. Chem. 2010, 2, 1007. doi: 10.1038/ NCHEM.913
-
[12]
Studer, A.; Curran, D. P. Angew. Chem. Int. Edit. 2011, 50, 5018. doi: 10.1002/anie.201101597
-
[13]
Pan, S. C. Beilstein J. Org. Chem. 2012, 8, 1374. doi: 10.3762/bjoc.8.159
-
[14]
Chan, T. L.; Wu, Y.; Choy, P. Y.; Kwong, F. Y. Chem. -Eur. J. 2013, 19, 15802. doi: 10.1002/chem.201301583
-
[15]
Sun, C. -L.; Shi, Z. -J. Chem. Rev. 2014, 114, 9219. doi: 10.1021/cr400274j
-
[16]
Hofmann, J.; Heinrich, M. R. Tetrahedron Lett. 2016, 57, 4334. doi: 10.1016/j.tetlet.2016.08.034
-
[17]
Qiu, Y.; Liu, Y.; Yang, K.; Hong, W.; Li, Z.; Wang, Z.; Yao, Z.; Jiang, S. Org. Lett. 2011, 13, 3556. doi: 10.1021/ol2009208
-
[18]
Liu, H.; Yin, B.; Gao, Z.; Li, Y.; Jiang, H. Chem. Commun. 2012, 48, 2033. doi: 10.1039/c2cc16790e
-
[19]
Ng, Y. S.; Chan, C. S.; Chan, K. S. Tetrahedron Lett. 2012, 53, 3911. doi: 10.1016/j.tetlet.2012.05.073
-
[20]
Tanimoro, K.; Ueno, M.; Takeda, K.; Kirihata, M.; Tanimori, S. J. Org. Chem. 2012, 77, 7844. doi: 10.1021/jo3008594
-
[21]
Chen, W. -C.; Hsu, Y. -C.; Shih, W. -C.; Lee, C. -Y.; Chuang, W. -H.; Tsai, Y. -F.; Chen, P. P. -Y.; Ong, T. -G. Chem. Commun. 2012, 48, 6702. doi: 10.1039/c2cc32519e
-
[22]
Sharma, S.; Kumar, M.; Kumar, V.; Kumar, N. Tetrahedron Lett. 2013, 54, 4868. doi: 10.1016/j.tetlet.2013.06.125
-
[23]
Liu, W.; Tian, F.; Wang, X.; Yu, H.; Bi, Y. Chem. Commun. 2013, 49, 2983. doi: 10.1039/c3cc40695d
-
[24]
Zhao, H.; Shen, J.; Guo, J.; Ye, R.; Zeng, H. Chem. Commun. 2013, 49, 2323. doi: 10.1039/c3cc00019b
-
[25]
Song, Q.; Zhang, D.; Zhu, Q.; Xu, Y. Org. Lett. 2014, 16, 5272. doi: 10.1021/ol502370r
-
[26]
Cuthbertson, J.; Gray, V. J.; Wilden, J. D. Chem. Commun. 2014, 50, 2575. doi: 10.1039/c3cc49019j
-
[27]
Wu, Y.; Choy, P. Y.; Kwong, F. Y. Org. Biomol. Chem. 2014, 12, 6820. doi: 10.1039/c4ob01211a
-
[28]
Yi, H.; Jutand, A.; Lei, A. Chem. Commun. 2015, 51, 545. doi: 10.1039/c4cc07299e
-
[29]
Zhou, S.; Anderson, G. M.; Mondal, B.; Doni, E.; Ironmonger, V.; Kranz, M.; Tuttle, T.; Murphy, J. A. Chem. Sci. 2014, 5, 476. doi: 10.1039/c3sc52315b
-
[30]
Zhou, S.; Doni, E.; Anderson, G. M.; Kane, R. G.; MacDougall, S. W.; Ironmonger, V. M.; Tuttle, T.; Murphy, J. A. J. Am. Chem. Soc. 2014, 136, 17818. doi: 10.1021/ja5101036
-
[31]
Barham, J. P.; Coulthard, G.; Emery, K. J.; Doni, E.; Cumine, F.; Nocera, G.; John, M. P.; Berlouis, L. E. A.; McGuire, T.; Tuttle, T.; et al. J. Am. Chem. Soc. 2016, 138, 7402. doi: 10.1021/jacs.6b03282
-
[32]
Gao, Y.; Tang, P.; Zhou, H.; Zhang, W.; Yang, H.; Yan, N.; Hu, G.; Mei, D.; Wang, J.; Ma, D. Angew. Chem. Int. Edit. 2016, 55, 3124. doi: 10.1002/anie.201510081
-
[33]
Paira, R.; Singh, B.; Hota, P. K.; Ahmed, J.; Sau, S. C.; Johnpeter, J. P.; Mandal, S. K. J. Org. Chem. 2016, 81, 2432. doi: 10.1021/acs.joc.6b00002
-
[34]
Zhang, L.; Yang, H.; Jiao, L. J. Am. Chem. Soc. 2016, 138, 7151. doi: 10.1021/jacs.6b03442
-
[35]
Yang, H.; Chu, D. -Z.; Jiao, L. Chem. Sci. 2018, 9, 1534. doi: 10.1039/c7sc04450j
-
[36]
Guo, Z. W.; Li, M.; Mou, X. Q.; He, G.; Xue, X. S.; Chen, G. Org. Lett. 2018, 20, 1684. doi: 10.1021/acs.orglett.8b00530
-
[37]
Hou, L.; Zhou, Z.; Wang, D.; Zhang, Y.; Chen, X.; Zhou, L.; Hong, Y.; Liu, W.; Hou, Y.; Tong, X. Org. Lett. 2017, 19, 6328. doi: 10.1021/acs.orglett.7b03135
-
[38]
Studer, A.; Curran, D. P. Nat. Chem. 2014, 6, 765. doi: 10.1038/NCHEM.2031
-
[39]
Hofmann, J.; Clark, T.; Heinrich, M. R. J. Org. Chem. 2016, 81, 9785. doi: 10.1021/acs.joc.6b01840
-
[40]
Roman, D. S.; Takahashi, Y.; Charette, A. B. Org. Lett. 2011, 13, 3242. doi: 10.1021/ol201160s
-
[41]
Sun, C. -L.; Gu, Y. -F.; Huang, W. -P.; Shi, Z. -J. Chem. Commun. 2011, 47, 9813. doi: 10.1039/c1cc13907j
-
[42]
Bhakuni, B. S.; Kumar, A.; Balkrishna, S. J.; Sheikh, J. A.; Konar, S.; Kumar, S. Org. Lett. 2012, 14, 2838. doi: 10.1021/ol301077y
-
[43]
Wu, Y.; Wong, S. M.; Mao, F.; Chan, T. L.; Kwong, F. Y. Org. Lett. 2012, 14, 5306. doi: 10.1021/ol302489n
-
[44]
De, S.; Ghosh, S.; Bhunia, S.; Sheikh, J. A.; Bisai, A. Org. Lett. 2012, 14, 4466. doi: 10.1021/ol3019677
-
[45]
Simmons, E. M.; Hartwig, J. F. Angew. Chem. Int. Edit. 2012, 51, 3066. doi: 10.1002/anie.201107334
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 9
- 文章访问数: 1040
- HTML全文浏览量: 48

 下载:
下载:

