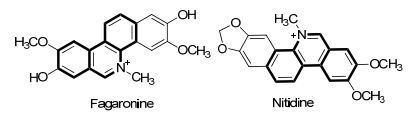
 图1
天然菲啶生物碱示例
Figure1.
Examples of naturally occuring phenanthridine alkaloids
图1
天然菲啶生物碱示例
Figure1.
Examples of naturally occuring phenanthridine alkaloids

Citation: Wu Yuqin, Yu Liangyun, Zhang Qi, Li Lidong. Synthesis of Dihydrophenanthridines by Palladium-Catalyzed[2+2+2] Cyclization Reactions[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2336-2342. doi: 10.6023/cjoc201703004

钯催化[2+2+2]环化反应制备5, 6-二氢苯并菲啶衍生物
English
Synthesis of Dihydrophenanthridines by Palladium-Catalyzed[2+2+2] Cyclization Reactions
-
Key words:
- palladium-catalyzed
- / synthesis
- / C-C coupling
- / dihydrophenanthridine
-
苯并菲啶类化合物作为一种生物碱被证实在药物化学中有广泛的应用, 一些含有苯并菲啶结构单元且具有生物活性的天然生物碱已经被报道[1].这些天然生物碱中最具有代表性的是花椒宁碱和两面针碱[2](图 1), 这两者都具有抗癌活性.一些苯并菲啶类化合物被开发应用于医药化学[3], 如被用于对抗分支杆菌类肺结核治疗的菲啶生物碱衍生物[4].具有特定结构的菲啶类化合物还被应用于铂族抗癌药物的连接剂[5].在一些催化反应中菲啶环还被用作催化剂的联接剂[6].
菲啶类化合物骨架的设计合成也引发了众多化学家的兴趣[7], 主要通过C—C/C—N偶联环化策略构建菲啶环骨架.过渡金属催化被广泛应用于这类偶联反应中, 特别是钯催化环化是最为常见的方法[8], 一些廉价金属诸如铁[9]、铜[10]等的催化也被深入研究.近年来无金属催化合成菲啶衍生物也被广泛报道[11].光催化合成[12]和微波合成[13]也被应用于菲啶环的合成中.环境友好的绿色合成被一些研究者重视, 如邻苯基苯胺盐和环酮在热水中直接反应[14]及无金属催化的室温反应[15].
多重炔烃是很多天然产物、医药分子及光学材料等分子的基本砌块[16], 我们课题组[17]在多炔串联环化反应研究中得到了系列芳构化产物. Deiters课题组[18]和Gong课题组[19]以二炔和单炔的[2+2+2]环化反应合成了菲啶骨架衍生物.芳卤在钯催化中由于易于芳钯化而被广泛应用于串联环化反应中[20], Hu课题组[21]报道了芳卤在钯催化下通过C—C偶联及C—H键活化实现多环化合物构建的系列工作.本工作通过对钯催化二炔与卤苯通过[2+2+2]环化反应合成了一系列5, 6-二氢苯并菲啶衍生物.
1 结果与讨论
1.1 反应条件优化
以底物4-甲基-N-(3-苯基炔丙基)-N-(2-(对甲苯乙炔基)苯基)苯磺酰胺和对溴苯乙酮的反应为模型, 对溶剂、反应温度、反应时间、碱及催化剂等不同反应条件进行了优化, 结果见表 1.首先考察了乙腈、甲苯、二甲基亚砜(DMSO)、N, N-二甲基甲酰胺(DMF)这几种溶剂对反应的影响(表 1, Entries 1~3, 7).发现在这几种溶剂中极性较大的DMF中效果最佳, 产物产率高达86%.而极性较强的DMSO为溶剂时, 薄层色谱(TLC)分析发现副反应较多, 产率明显降低.接着探讨不同温度对反应的影响, 发现130 ℃为最佳反应温度(表 1, Entries 7), 温度升至140℃时产率下降.在其它最优条件下发现4 h为适宜反应时间.在确定反应的最佳溶剂、温度和反应时间后, 又考察不同催化剂对反应的影响(表 1, Entries 7, 11~12), 当不使用催化剂时该反应无法启动, 分别用Pd(OAc)2/PPh3、Pd(PPh3)4、PdCl2/ PPh3、Pd(OAc)2不同钯源催化剂进行催化反应, 结果表明不同催化剂催化效果不同, 其中发现Pd(OAc)2/PPh3 (1:2, 物质的量比)作为催化体系效果最佳, 且Pd(OAc)2/PPh3 (1:2, 物质的量比)最佳催化的等物质的量为2 mol%.最后考察不同添加剂碱对反应收率的影响(表 1, Entries 5, 15~16), 发现有机碱正三丁胺对反应的催化循环促进作用较好, 正三丁胺的用量为2 equiv.时反应最佳, 其用量减少时反应时间延长, 产率降低.用三乙胺、吡啶为有机碱时, 由于较低的沸点在反应中易于挥发反应不能完全充分.当用无机碱NaHCO3、Cs2CO3代替有机碱时, 产率则显著降低.最终确定该反应体系的最优条件: 1 equiv.二炔底物, 1.2 equiv.卤苯衍生物, 2 mol% Pd(OAc)2/PPh3 (1:2, 物质的量比), 2 equiv. (n-Bu)3N, 于氩气保护下, 在DMF溶剂中于130 ℃反应24 h.

Entry Catalyst (molar ratio) Base (equiv.) Solvent t/h Tb/℃ Yieldc/% 1 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) MeCN 24 90 0 2 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) Toluene 24 120 38 3 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMSO 24 130 14 4 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 95 7 5 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 110 28 6 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 120 53 7 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 130 88 8 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 140 81 9 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 20 130 79 10 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 28 130 87 11 Pd(OAc)2/PPh3 (1:2) (n-Bu)3N (2) DMF 24 130 56 12 Pd(PPh3)4 (2) (n-Bu)3N (2) DMF 24 130 21 13 PdCl2 (2) (n-Bu)3N (2) DMF 24 130 0 14 Pd(OAc)2 (2) (n-Bu)3N (2) DMF 24 130 6 15 Pd(OAc)2/PPh3 (2:4) NaHCO3 (2) DMF 24 130 Trace 16 Pd(OAc)2/PPh3 (2:4) Cs2CO3 (2) DMF 24 130 6 a General conditions: substrate 1 (1.0 mmol), substrate 2 (1.2 mmol), catalyst (1~2 mmol%) and alkali (2 mmol) in 5 mL of solvent under argon. b Oil bath temperature. c Isolated yield. 1.2 反应底物的适用范围
在上述最优反应条件下, 考察了不同结构底物在钯催化的Domino反应中对产物产率的影响, 主要从底物1两个炔基末端苯环上连接不同类型取代基以及底物2中取代溴苯中取代基类型及取代基的位置来分析其对反应产率的影响, 其对钯催化C—C偶联构筑5, 6-二氢苯并菲啶骨架反应的影响结果见表 2.从表中得到的结果可以看出, 不同底物结构在钯催化下均能有效进行C—C偶联反应, 并以68%~88%的高产率得到5, 6-二氢苯并菲啶骨架的产物.底物1两个炔基末端芳环上无论是连有供电子基还是吸电子基, 对产物产率影响不大.底物2中R3为甲基这样的供电子基时, 不发生该环化反应, 芳环上取代基为CHO, COMe, COOEt, CN这样的吸电子基时, 反应则能顺利发生.但是底物2中R3与溴的不同位置由于空间位阻的原因对反应的发生或反应产率有显著的影响, R3与溴为对位时, 空间位阻较小, 反应产率较高, 大多在80%以上; R3与溴为邻位时, 空间位阻最大, 此时不能得到反应产物.为了进一步拓展底物范围, 我们尝试将底物1炔基末端的芳环更换为烷基, 结果发现在TLC分析板上呈现很多杂点, 未能分离出有效产物.由此看出钯催化的C—C偶联反应中对两种底物的结构具有一定的要求, 尤其是底物2中芳环上取代基为吸电子基时, 且位置为间、对位时反应容易发生.

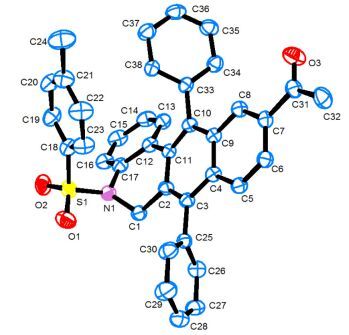
Entry R1 R2 R3 Product Yieldb/% 1 H H m-CN 3a 83 2 H H p-COMe 3b 85 3 H H p-CHO 3c 77 4 H Cl p-CO2Et 3d 81 5 H F p-CN 3e 79 6 H Me m-COMe 3f 71 7 H Me p-COMe 3g 88 8 F H p-CN 3h 85 9 Me F p-CN 3i 84 10 Me F m-CN 3j 69 11 Me H m-COMe 3k 68 12 Me H p-COMe 3l 87 13 F Me p-COMe 3m 85 14 EtO Me p-CN 3n 73 a General conditions: substrate 1 (1.0 mmol), substrate 2 (1.2 mmol), Pd(OAc)2 (2 mmol%), PPh3 (4 mmol%) and N(n-Bu)3 (2 mmol) in 5 mL of DMF at 130℃ for 24 h under argon. b Yield of the isolated product after flash column chromatography. 底物2中R3基团与卤原子为间位时, 由于空间位阻的原因, 使得这两个间位基团另一侧的芳环氢更易于被活化从而生成芳环碳与炔碳偶联的环化产物.通过对底物1、2芳环上基团的拓展, 我们最终合成了14个5, 6-二氢苯并菲啶产物, 这些产物的结构经IR、1H NMR、13C NMR和HRMS表征确证, 其中化合物3b的结构还通过X射线单晶衍射分析确认.化合物3b的晶体结构见图 2, 其晶体学数据存于英国剑桥数据中心, CCDC号为965258.
1.3 反应机理
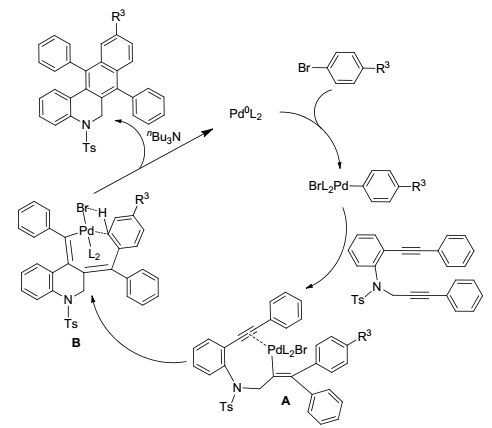
以底物1a (R1=H, R2=H)为模板探讨了钯催化二炔和溴苯衍生物构筑5, 6-二氢苯并菲啶骨架反应的可能机理(Scheme 1).首先, 溴苯衍生物与体系中的零价钯发生氧化加成反应生成芳基钯中间体.底物中有两个碳碳叁键, 由于烷基炔叁键的共轭程度相对较低, 其叁键的外围电子云密度相对较高, 因此芳基钯中间体先与二炔化合物底物中的烷基炔叁键发生反应, 生成钯中间体A; 接着钯中间体A再与二炔的另一个叁键发生加成反应, 得到环状钯中间体化合物B, 中间体B中在金属钯作用下活化芳环的C—H键并通过一个σ键转换形成钯四元环过渡态[22a, 23], 最后在有机碱作用下, 钯中间体化合物B发生还原消除释放出Pd(0) 并得到最终产物的稠环产物.
2 结论
以结构简单多样的氮连二炔为底物, 在Pd(OAc)2催化下经历三步C—C偶联和一步C—H键活化的串联环化反应合成了一系列5, 6-二氢苯并菲啶衍生物.该反应操作便捷、高效实用, 为具有潜在生物活性的5, 6-二氢苯并菲啶衍生物合成提供了一条实用并具有原子经济性的途径.
3 实验部分
3.1 仪器与试剂
仪器:熔点用XT-4型双目显微熔点仪测定; 红外光谱用Nicole Avatar 360傅立叶变换红外光谱仪测定(KBr压片); 核磁共振谱用Bruker Avance 300型核磁共振谱仪测定, CDCl3为溶剂, 四甲基硅烷(TMS)为内标; 高分辨质谱用Agilent 6220质谱仪测定, APCI电离方式.柱层析硅胶用300~400目.
试剂:醋酸钯等钯催化剂(进口试剂); 三苯基膦(百灵威试剂公司); 邻碘苯胺、对甲基苯磺酰氯、溴苯化合物(上海柏卡化学技术公司); 苯乙炔衍生物(阿拉丁试剂公司); 其它试剂为市售分析纯试剂.
3.2 实验方法
5, 6-二氢苯并菲啶化合物的一般合成步骤:在25 mL的Schlenk反应管中加入一定质量二炔底物(1 mmol)、Pd(OAc)2 (2 mmol%)、PPh3 (4 mmol%)、溴苯化合物(1.2 mmol), 反复充放氩气三次, 然后用注射器分别注入N, N-二甲基甲酰胺(5 mL)、正三丁胺(2 mmol), 室温搅拌0.5 h后油浴加热至130 ℃, 此温度下反应24 h停止加热, 冷至室温, 用水淬灭反应, 反应混合液液分别用20 mL 5% HCl溶液、20 mL 5% NaHCO3溶液、20 mL饱和NaCl溶液洗涤, 再用90 mL乙酸乙酯分三次萃取, 经无水MgSO4干燥后减压蒸馏去除溶剂, 然后用硅胶柱层析分离粗产物[V(石油醚):V(乙酸乙酯)=20:1]得到纯化的5, 6-二氢苯并菲啶产物3a~3n.
7, 12-二苯基-5-对甲苯磺基-5, 6-二氢苯并[j]菲啶-10-甲腈(3a):白色固体, 产率83%. m.p. 262~263 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.88 (s, 1H), 7.72~7.59 (m, 5H), 7.51~7.38 (m, 6H), 7.25~7.16 (m, 3H), 6.81~6.65 (m, 6H), 4.74 (s, 2H), 2.04 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 143.5, 138.0, 136.5, 136.3, 135.9, 134.4, 133.0, 131.8, 130.6, 130.2, 130.1, 129.4, 129.3, 129.2, 129.1, 128.9, 128.8, 128.7, 128.5, 128.2, 127.6, 127.3, 126.5, 125.7, 119.4, 109.2, 49.6, 21.2; IR (KBr) ν: 3022.5, 1593.2, 1456.3, 1352.1, 1159.2, 1084.0, 1010.7, 854.5, 810.1, 773.5, 665.4 cm-1. HRMS (APCI) calcd for C37H27N2O2S[M+H]+ 563.1788, found 563.1778.
7, 12-二苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-乙酮(3b):白色固体, 产率85%. m.p. 245~246 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.14 (s, 1H), 7.92~7.88 (m, 1H), 7.73 (d, J=7.8 Hz, 1H), 7.66~7.58 (m, 4H), 7.44~7.39 (m, 5H), 7.21 (d, J=7.8 Hz, 3H), 6.81~6.68 (m, 6H), 4.74 (s, 2H), 2.46 (s, 3H), 2.00 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 198.1, 143.3, 138.7, 137.9, 137.6, 136.9, 136.1, 136.0, 134.2, 133.8, 131.9, 130.8, 130.2, 130.1, 129.1, 128.9, 128.8, 128.7, 128.5, 128.2, 128.0, 127.5, 127.3, 126.8, 125.6, 124.1, 49.6, 26.5, 21.2; IR (KBr) ν: 3059.1, 2918.3, 1678.1, 1602.9, 1481.3, 1415.8, 1356.0, 1242.2, 1165.0, 1091.7, 893.0, 848.7, 814.0, 706.0, 650.0 cm-1; HRMS (APCI) calcd for C38H30NO3S[M+ H]+ 580.1941, found 580.1932.
7, 12-二苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-甲醛(3c):白色固体, 产率77%. m.p. 243~244 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.50 (s, 1H), 7.72~7.58 (m, 6H), 7.48~7.42 (m, 6H), 7.21 (d, J=4.5 Hz, 2H), 6.81~6.69 (m, 6H), 4.75 (s, 2H), 2.00 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 195.3, 149.3, 143.2, 139.1, 137.9, 137.0, 136.7, 136.1, 132.0, 131.8, 130.7, 130.2, 130.0, 129.2, 129.1, 128.9, 128.7, 128.6, 128.5, 128.4, 128.1, 127.8, 127.5, 127.4, 126.8, 125.6, 49.6, 21.1; IR (KBr) ν: 3061.0, 2958.8, 1680.0, 1340.5, 1161.2, 1084.0, 810.1, 702.1, 567.1 cm-1; HRMS (APCI) calcd for C37H28NO3S[M+H]+ 566.1784, found 566.1778.
12-苯基-7-对氯苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-乙酸乙酯(3d):白色固体, 产率81%. m.p. 201~202 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.31 (s, 1H), 7.96 (d, J=8.7 Hz, 1H), 7.72~7.52 (m, 4H), 7.41~7.34 (m, 5H), 7.22 (s, 1H), 7.18 (d, J=8.1 Hz, 2H), 6.80~6.65 (m, 6H), 4.71 (s, 2H), 4.34 (q, J=6.9 Hz, 2H), 2.02 (s, 3H), 1.34 (t, J=6.9 Hz, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 166.5, 143.5, 138.5, 137.9, 137.8, 136.0, 135.5, 134.7, 134.6, 133.7, 133.6, 131.9, 131.6, 130.8, 130.5, 130.2, 129.9, 129.4, 128.7, 128.2, 128.2, 127.9, 127.8, 127.5, 127.4, 127.3, 126.1, 125.7, 125.6, 61.1, 49.5, 21.2, 14.2; (KBr) ν: 3032.1, 2982.0, 1714.7, 1595.1, 1479.4, 1442.8, 1346.3, 1296.2, 1261.5, 1161.2, 1087.9, 893.0, 833.3, 812.0, 756.1, 706.0, 684.7 cm-1; HRMS (APCI) calcd for C39H31ClNO4S[M+H]+644.1657, found 644.1652.
12-苯基-7-对氟苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-甲腈(3e):白色固体, 产率79%. m.p. 269~270 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.89 (s, 1H), 7.79 (d, J=8.1 Hz, 1H), 7.72 (d, J=7.5 Hz, 1H), 7.61 (d, J=9.0 Hz, 1H), 7.52~7.36 (m, 7H), 7.22~7.14 (m, 3H), 6.81~6.66 (m, 6H), 4.72 (s, 2H), 2.06 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 164.6 (d, JC-F=249.1 Hz), 143.6, 138.0, 137.9, 136.8, 136.0, 135.1, 134.8, 133.1, 132.9, 131.9, 131.8, 130.6, 130.1, 130.0, 129.1, 128.9, 128.7, 128.6, 128.3, 128.0, 127.4, 127.3, 126.7, 125.7, 119.2, 116.6, 116.3, 109.4, 49.5, 21.2; (KBr) ν: 3030.2, 2883.6, 1597.1, 1479.4, 1350.2, 1165.0, 1076.3, 848.7, 763.8, 704.0, 667.4 cm-1; HRMS (APCI) calcd for C37H26FN2O2S[M+H]+ 581.1694, found 581.1698.
12-苯基-7-对甲苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-9-乙酮(3f):白色固体, 产率71%. m.p. 243~244 ℃; 1H NMR (300 MHz, CDCl3) δ:8.22 (s, 1H), 7.86 (d, J=9.0 Hz, 1H), 7.73 (d, J=7.8 Hz, 1H), 7.55 (d, J=9.0 Hz, 1H), 7.47~7.41 (m, 5H), 7.32~7.15 (m, 5H), 6.80~6.66 (m, 6H), 4.76 (s, 2H), 2.55 (s, 3H), 2.53 (s, 3H), 1.98 (s, 3H); 13C NMR (75.5 MHz, CDCl3)δ: 198.1, 143.3, 139.0, 138.4, 138.1, 137.7, 136.0, 135.8, 134.8, 134.4, 133.6, 132.1, 131.1, 130.8, 130.7, 130.6, 130.2, 130.1, 129.9, 129.7, 128.8, 128.7, 128.4, 128.3, 127.7, 127.6, 127.3, 125.6, 123.5, 49.6, 26.6, 21.5, 21.1; (KBr) ν: 3024.4, 2922.2, 1674.2, 1610.6, 1352.1, 1253.7, 1163.1, 1085.9, 891.1, 833.3, 763.8, 706.0, 661.6 cm-1; HRMS (APCI) calcd for C39H32NO3S[M+H]+594.2097, found 94.2085.
12-苯基-7-对甲苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-乙酮(3g):白色固体, 产率88%. m.p. 253~254 ℃; 1H NMR (300 MHz, CDCl3)δ: 8.13 (s, 1H), 7.91 (d, J=9.0 Hz, 1H), 7.73~7.63 (m, 2H), 7.43 (s, 5H), 7.29~7.18 (m, 5H), 6.81~6.67 (m, 6H), 4.75 (s, 2H), 2.53 (s, 3H), 2.46 (s, 3H), 1.98 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 198.1, 143.3, 138.8, 138.3, 137.9, 137.4, 136.2, 136.1, 134.2, 134.0, 133.9, 133.8, 131.9, 130.8, 130.6, 130.1, 130.0, 129.8, 128.9, 128.8, 128.7, 128.3, 128.1, 127.9, 127.6, 127.3, 126.9, 125.6, 124.0, 49.7, 26.5, 21.5, 21.1; (KBr) ν: 3026.3, 2995.5, 2918.3, 1683.9, 1602.9. 1413.8, 1342.5, 1238.3, 1157.3, 1076.3, 848.7, 812.0, 773.5, 692.4, 667.4 cm-1; HRMS (APCI) calcd for C39H32NO3S[M+H]+ 594.2097, found 594.2090.
7-苯基-12-对氟苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-甲腈(3h):白色固体, 产率85%. m.p. 244~245 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.86 (s, 1H), 7.73 (d, J=8.1 Hz, 1H), 7.66~7.59 (m, 4H), 7.52 (d, J=8.7 Hz, 1H), 7.40 (d, J=6.0 Hz, 2H), 7.24~7.11 (m, 5H), 6.87~6.64 (m, 6H), 4.73 (s, 2H), 2.05 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 164.2 (d, JC-F=248.5 Hz), 143.5, 138.1, 136.6, 136.2, 136.0, 135.3, 134.7, 133.9, 133.8, 133.0, 132.6, 132.5, 132.4, 131.8, 130.1, 130.0, 129.3, 128.8, 128.7, 127.8, 127.7, 127.4, 126.6, 125.8, 119.2, 116.4, 116.1, 109.5, 49.6, 21.2; (KBr) ν: 3030.2, 2960.7, 1597.0, 1479.4, 1398.4, 1354.0, 1290.4, 1153.4, 1084.0, 895.0, 846.8, 761.9, 706.0, 655.8 cm-1; HRMS (APCI) calcd for C37H26FN2O2S[M+H]+ 581.1694, found 581.1688.
12-对甲苯基-7-对氟苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-9-甲腈(3i):白色固体, 产率84%. m.p. 224~225 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.86 (d, J=6.3 Hz, 1H), 7.71 (d, J=7.5 Hz, 1H), 7.62 (d, J=9.0 Hz, 1H), 7.45 (d, J=8.1 Hz, 1H), 7.37 (d, J=6.3 Hz, 4H), 7.23~7.14 (m, 6H), 6.81~6.72 (m, 5H), 4.70 (s, 2H), 2.45 (s, 3H), 2.02 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 164.6 (d, JC-F=244.8 Hz), 143.5, 138.1, 137.8, 136.5, 135.9, 135.1, 134.2, 133.3, 132.1, 131.9, 131.8, 131.4, 130.9, 130.5, 130.4, 130.2, 129.7, 128.8, 128.7, 128.2, 127.5, 127.3, 126.2, 125.7, 119.2, 116.7, 116.4, 109.6, 49.4, 21.4, 21.2; (KBr) ν: 2920.2, 1602.9, 1510.3, 1357.9, 1224.8, 1165.0, 1087.9, 893.0, 844.8, 761.9, 709.8, 663.5 cm-1; HRMS (APCI) calcd for C38H28FN2O2S[M+H]+595.1850, found 595.1851.
12-对甲苯基-7-对氟苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-甲腈(3j):白色固体, 产率69%. m.p. 246~247 ℃; 1H NMR (300 MHz, CDCl3) δ:7.91 (s, 1H), 7.72 (d, J=8.4 Hz, 1H), 7.60 (d, J=8.7 Hz, 1H), 7.52 (d, J=9.0 Hz, 1H), 7.37~7.34 (m, 4H), 7.24~7.12 (m, 5H), 6.85~6.72 (m, 6H), 4.72 (s, 2H), 2.47 (s, 3H), 2.05 (s, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 164.5 (d, JC-F=249.0 Hz), 143.6, 138.1, 137.9, 137.0, 135.9, 135.0, 134.8, 133.2, 133.1, 132.3, 132.2, 132.0, 131.9, 131.8, 130.4, 130.2, 129.8, 129.2, 128.7, 128.5, 127.4, 127.3, 126.6, 125.8, 119.3, 116.6, 116.3, 109.3, 49.5, 21.4, 21.2; (KBr) ν: 3030.2, 2920.2, 1602.9, 1510.3, 1458.2, 1350.2, 1292.3, 1222.9, 1082.1, 896.9, 842.9, 814.0, 761.9, 707.9, 690.5, 657.7 cm-1; HRMS (APCI) calcd for C38H28FN2O2S[M+H]+ 595.1850, found 595.1845.
7-苯基-12-对甲苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-9-乙酮(3k):白色固体, 产率68%. m.p. 206~207 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.16 (s, ArH, 1H), 7.86~7.82 (m, 1H), 7.70~7.55 (m, 5H), 7.44 (d, J=7.2 Hz, 2H) 7.23~7.15 (m, 5H), 6.81~6.69 (m, 6H), 4.73 (s, 2H), 2.48 (s, 3H), 2.47 (s, 3H), 1.99 (s, 3H); 13C NMR (75.5 MHz, CDCl3)δ: 198.1, 143.3, 138.0, 137.5, 137.4, 136.7, 136.2, 136.0, 135.8, 134.9, 134.4, 132.0, 131.0, 130.8, 130.6, 130.2, 129.7, 129.5, 129.3, 129.1, 128.7, 128.3, 128.2, 127.6, 127.4, 127.3, 127.1, 125.6, 123.4, 49.6, 26.5, 21.3, 21.1; IR (KBr) ν: 3051.4, 2916.4, 1674.2, 1612.5, 1442.8, 1356.0, 1255.7, 1163.1, 1085.9, 839.0, 761.9, 706.0, 667.4 cm-1; HRMS (APCI) calcd for C39H32NO3S[M+H]+ 594.2097, found 594.2107.
7-苯基-12-对甲苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-乙酮(3l):白色固体, 产率87%. m.p. 241~242 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.18 (s, 1H), 7.90 (d, J=8.7 Hz, 1H), 7.72 (d, J=8.1 Hz, 1H), 7.66~7.58 (m, 4H), 7.40 (d, J=6.3 Hz, 2H), 7.25~7.17 (m, 5H), 6.83~6.71 (m, 6H), 4.73 (s, 2H), 2.48 (s, 3H), 2.47 (s, 3H), 1.99 (s, 3H); 13C NMR (75.5 MHz, CDCl3)δ:198.1, 143.3, 137.8, 137.7, 137.6, 136.9, 136.0, 135.9, 135.5, 134.4, 134.1, 133.8, 132.0, 131.0, 130.7, 130.2, 129.5, 129.1, 129.0, 128.7, 128.5, 128.3, 128.1, 127.5, 127.3, 126.8, 125.6, 124.1, 123.5, 49.7, 26.6, 21.4, 21.1; IR (KBr) ν: 3036.0, 2920.2, 1683.9, 1604.8, 1348.2, 1242.2, 1165.0, 1089.8, 891.1, 810.1, 756.1, 669.3 cm-1; HRMS (APCI) calcd for C39H32NO3S[M+H]+ 594.2097, found 594.2096.
7-对甲苯基-12-对氟苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-乙酮(3m):白色固体, 产率85%. m.p. 244~245 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.11 (s, 1H), 7.91 (d, J=8.7 Hz, 1H), 7.73~7.64 (m, 2H), 7.45 (d, J=7.5 Hz, 2H), 7.29~7.10 (m, 7H), 6.83 (t, J=7.8 Hz, 2H), 6.72~6.64 (m, 4H), 4.75 (s, 2H), 2.53 (s, 3H), 2.50 (s, 3H), 1.99 (s, 3H); 13C NMR (75.5 MHz, CDCl3)δ:197.9, 164.1 (d, JC-F=251.5 Hz), 143.3, 138.4, 138.0, 136.5, 136.2, 136.1, 134.7, 134.6, 134.3, 134.0, 133.7, 132.6, 132.5, 131.9, 130.5, 130.0, 129.9, 128.6, 128.3, 128.2, 127.7, 127.3, 127.0, 125.7, 124.2, 116.1, 115.8, 49.7, 26.5, 21.4, 21.1; IR (KBr) ν: 3030.2, 2993.5, 2918.3, 1683.9, 1602.9, 1512.2, 1344.4, 1238.3, 1165.0, 1076.3, 858.3, 721.4, 657.7 cm-1; HRMS (APCI) calcd for C39H31FNO3S [M+H]+ 612.2003, found 612.2003.
7-对甲苯基-12-对乙氧苯基-5-对甲苯磺酰基-5, 6-二氢苯并[j]菲啶-10-甲腈(3n):白色固体, 产率73%. m.p. 236~237 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.92 (s, 1H), 7.79 (d, J=8.4 Hz, 1H), 7.72~7.64 (m, 2H), 7.49 (s, 1H), 7.45 (d, J=7.2 Hz, 2H), 7.24~7.15 (m, 5H), 6.95 (d, J=7.5 Hz, 2H), 6.84 (t, J=7.5 Hz, 1H), 6.72 (t, J=8.7 Hz, 4H), 4.73 (s, 2H), 4.16 (q, J=6.9 Hz, 2H), 2.01 (s, 3H), 2.53 (s, 3H), 1.50 (t, J=6.9 Hz, 3H); 13C NMR (75.5 MHz, CDCl3) δ: 158.9, 143.4, 138.5, 138.0, 136.1, 136.0, 134.6, 133.3, 133.2, 133.1, 132.9, 132.2, 131.8, 130.4, 130.1, 130.0, 129.9, 129.8, 129.3, 128.7, 128.3, 128.0, 127.6, 127.3, 126.3, 125.8, 119.4, 115.0, 109.1, 63.7, 49.7, 21.4, 21.2, 14.9; IR (KBr) ν: 2978.1, 2881.7, 1608.6, 1508.3, 1354.0, 1246.0, 1168.9, 1089.8, 817.8, 707.9, 657.7 cm-1; HRMS (APCI) calcd for C40H33N2O3S[M+H]+ 6221.2206, found 621.2207.
辅助材料(Supporting Information)化合物3的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Simeon, S.; Rios, J. L.; Villar, A. Pharmazie 1989, 44, 593.
(b) Ishikawa, T.; Ishii, H. Heterocycles 1999, 50, 627. -
[2]
(a) Phillips, S. D.; Castle, R. N. J. Heterocycl. Chem. 1981, 18, 223.
(b) Treus, M.; Estevez, J. C.; Castedo, L.; Esteves, R. J. Tetrahedron Lett. 2002, 43, 532. -
[3]
(a) Bernardo, P. H.; Wan, K.-F.; Sivaraman, T.; Xu, J.; Moore, F. K.; Hung, A. W.; Mok, H. Y. K.; Yu, V. C.; Chai, C. L. L. J. Med. Chem. 2008, 51, 6699.
(b) Janin, Y. L.; Croisy, A.; Riou, J.-F.; Bisagni, E. J. Med. Chem. 1993, 36, 3686.
(c) Kock, I.; Heber, D.; Weide, M.; Wolschendorf, U.; Clement, B. J. Med. Chem. 2005, 48, 2772.
(d) Treus, M.; Estevez, J. C.; Castedo, L.; Esteves, R. J. Tetrahedron Lett. 2002, 43, 5323.
(e) Nakanishi, T.; Suzuki, M. Org. Lett. 1999, 1, 985. -
[4]
Cappoen, D.; Claes, P.; Jacobs, J.; Anthonissen, R.; Mathys, V.; Verschaeve, L.; Huygen, K.; Kimpe, N. D. J. Med. Chem. 2014, 57, 2895. doi: 10.1021/jm401735w
-
[5]
Czapar, A. E.; Zheng, Y.-R.; Riddell, I. A.; Shukla, S.; Awuah, S. G.; Lippard, S. J.; Steinmetz, N. F. ACS Nano 2016, 10, 4119. doi: 10.1021/acsnano.5b07360
-
[6]
Jiang, H.; He, J.; Liu, T.; Yu, J.-Q. J. Am. Chem. Soc. 2016, 138, 2055. doi: 10.1021/jacs.5b13462
-
[7]
(a) Tobisu, M. ; Koh, K. ; Furukawa, T. ; Chatani, N. Angew. Chem. , Int. Ed. 2012, 51, 11363.
(b) Cheng, Y. ; Jiang, H. ; Zhang, Y. ; Yu, S. Org. Lett. 2013, 15, 5520.
(c) Zhu, T. -H. ; Wang, S. -Y. ; Tao, Y. -Q. ; Wei, T. -Q. ; Ji, S. -J. Org. Lett. 2014, 16, 1260.
(d) Pan, C. ; Han, J. ; Zhang, H. ; Zhu, C. J. Org. Chem. 2014, 79, 5374.
(e) Li, J. ; He, Y. ; Luo, S. ; Lei, J. ; Wang, J. ; Xi, Z. ; Zhu, Q. J. Org. Chem. 2015, 80, 2223.
(f) Ma, L. ; Lv, W. ; Huang, D. ; Niu, T. ; Su, Y. ; Wang, K. ; Hu, Y. Chin. J. Org. Chem. 2014, 34, 962(in Chinese).
(马丽芳, 吕文贤, 黄丹凤, 牛腾, 苏嬴鹏, 王克虎, 胡雨来, 有机化学, 2014, 34, 962. ) -
[8]
(a) Clement, B.; Weide, M.; Wolschendorf, U.; Kock, I. Angew. Chem., Int. Ed. 2005, 44, 635.
(b) Candito, D. A.; Lautens, M. Angew. Chem., Int. Ed. 2009, 48, 6713.
(c) Guo, C.; Huang, K.; Wang, B.; Xie, L.; Xu, X. RSC Adv. 2013, 3, 17271.
(d) Gu, J.-W.; Zhang, X. Org. Lett. 2015, 17, 5384. -
[9]
(a) Deb, I.; Yoshikai, N. Org. Lett. 2013, 15, 4254.
(b) Tu, H.-Y.; Liu, Y.-R.; Chu, J.-J.; Hu, B.-L.; Zhang, X.-G. J. Org. Chem. 2014, 79, 9907.
(c) Wang, G.; Chen, S.-Y.; Yu, X.-Q. Tetrahedron Lett. 2014, 55, 5338.
(d) Nie, Z.; Ding, Q.; Peng, Y. Tetrahedron, 2016, 72, 8350. -
[10]
Zhang, L.; Ang, G. Y.; Chiba, S. Org. Lett. 2010, 12, 3682. doi: 10.1021/ol101490n
-
[11]
(a) Fang, H.; Zhao, J.; Ni, S.; Mei, H.; Han, J.; Pan, Y. J. Org. Chem. 2015, 80, 3151.
(b) Lu, S.; Gong, Y.; Zhou, D. J. Org. Chem. 2015, 80, 9336.
(c) Zhou, Y.; Wu, C.; Dong, X.; Qu, J. J. Org. Chem. 2016, 81, 5202.
(d) Xiao, P.; Jian, Rong.; Ni, C.; Guo, J.; Li, X.; Chen, D.; Hu, J. Org. Lett. 2016, 18, 5912. -
[12]
(a) Linsenmeier, A. M.; Williams, C. M.; Bräse, S. J. Org. Chem. 2011, 76, 9127.
(b) Zhang, Z.; Tang, X.; Dolbier, W. R., Jr. Org. Lett. 2015, 17, 4401.
(c) Cheng, P.; Qing, Z.; Liu, S.; Liu, W.; Xie, H.; Zeng, J. Tetrahedron Lett. 2014, 55, 6647. -
[13]
(a) Read, M. L.; Gundersen, L.-L. J. Org. Chem. 2013, 78, 1311.
(b) Xu, Y.; Chen, Y.; Li, W.; Xie, Q.; Shao, L. J. Org. Chem. 2016, 81, 8426. -
[14]
Mehta, B. K.; Yanagisawa, K.; Shiro, M.; Kotsuki, H. Org. Lett. 2003, 5, 1605. doi: 10.1021/ol0300120
-
[15]
Tummatorn, J.; Krajangsri, S.; Norseeda, K.; Thongsornkleeb, C.; Ruchirawat, S. Org. Biomol. Chem. 2014, 45, 5077.
-
[16]
(a) Bras, J. L.; Muzart, J. Chem. Rev. 2011, 111, 1170.
(b) Platon, M.; Amardeil, R.; Djakovitch, L.; Hierso, J.-C. Chem. Soc. Rev. 2012, 41, 3929. -
[17]
(a) Zhang, H. ; Hu, Q. ; Li, L. ; Hu, Y. ; Zhou, P. ; Zhang, X. ; Xie, H. ; Yin, F. ; Hu, Y. ; Wang, S. Chem. Commun. 2014, 50, 3335.
(b) Hu, Y. ; Ma, J. ; Li, L. ; Hu, Q. ; Lv, S. ; Liu, B. ; Wang, S. Chem. Commun. 2017, 53, 1542.
(c) Wu, Y. ; Yu, L. ; Zhang, Q. ; Li, L. Chin. J. Org. Chem. 2015, 35, 724(in Chinese).
(吴玉芹, 于凉云, 张奇, 李立冬, 有机化学, 2015, 35, 724. )
(d) Wu, Y. ; Yang, Y. ; Li, L. Chin. J. Org. Chem. 2015, 35, 2333(in Chinese).
(吴玉芹, 杨永, 李立冬, 有机化学, 2015, 35, 2333. ) -
[18]
Sripada, L.; Teske, A. J.; Deiters, A. Org. Biomol. Chem. 2008, 6, 263. doi: 10.1039/B716519F
-
[19]
Li, Y.; Zhu, J.; Zhang, L.; Wu, Y.; Gong, Y. Chem. Eur. J. 2013, 19, 8294. doi: 10.1002/chem.v19.25
-
[20]
(a) Bedford, R. B.; Betham, M. J. Org. Chem. 2006, 71, 9403.
(b) Gandeepan, P.; Parthasarathy, K.; Cheng, C.-H. J. Am. Chem. Soc. 2010, 132, 8569. -
[21]
(a) Hu, Y.; Ren, D.; Zhang, L.; Lin, X.; Wan J. Eur. J. Org. Chem. 2010, 23, 4454.
(b) Hu, Y.; Yao, H.; Sun, Y.; Wan, J.; Lin, X, ; Zhu, T. Chem. Eur. J. 2010, 16, 7635. -
[22]
(a) Garca-Cuadrado, D.; Braga, A. A. C.; Maseras, F.; Echavarren, A. M. J. Am. Chem. Soc. 2006, 128, 1066.
(b) Garca-Cuadrado, D.; Mendoza, P. D.; Braga, A. A. C.; Maseras, F.; Echavarren, A. M. J. Am. Chem. Soc. 2007, 129, 6880.
-
[1]
-
表 1 钯催化反应条件的优化a
Table 1. Optimization of reaction conditions for the palladium-catalyzed reaction

Entry Catalyst (molar ratio) Base (equiv.) Solvent t/h Tb/℃ Yieldc/% 1 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) MeCN 24 90 0 2 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) Toluene 24 120 38 3 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMSO 24 130 14 4 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 95 7 5 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 110 28 6 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 120 53 7 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 130 88 8 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 24 140 81 9 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 20 130 79 10 Pd(OAc)2/PPh3 (2:4) (n-Bu)3N (2) DMF 28 130 87 11 Pd(OAc)2/PPh3 (1:2) (n-Bu)3N (2) DMF 24 130 56 12 Pd(PPh3)4 (2) (n-Bu)3N (2) DMF 24 130 21 13 PdCl2 (2) (n-Bu)3N (2) DMF 24 130 0 14 Pd(OAc)2 (2) (n-Bu)3N (2) DMF 24 130 6 15 Pd(OAc)2/PPh3 (2:4) NaHCO3 (2) DMF 24 130 Trace 16 Pd(OAc)2/PPh3 (2:4) Cs2CO3 (2) DMF 24 130 6 a General conditions: substrate 1 (1.0 mmol), substrate 2 (1.2 mmol), catalyst (1~2 mmol%) and alkali (2 mmol) in 5 mL of solvent under argon. b Oil bath temperature. c Isolated yield. 表 2 从二炔合成二氢菲啶衍生物a
Table 2. Synthesis of the dihydrophenanthridine derivatives from diynes

Entry R1 R2 R3 Product Yieldb/% 1 H H m-CN 3a 83 2 H H p-COMe 3b 85 3 H H p-CHO 3c 77 4 H Cl p-CO2Et 3d 81 5 H F p-CN 3e 79 6 H Me m-COMe 3f 71 7 H Me p-COMe 3g 88 8 F H p-CN 3h 85 9 Me F p-CN 3i 84 10 Me F m-CN 3j 69 11 Me H m-COMe 3k 68 12 Me H p-COMe 3l 87 13 F Me p-COMe 3m 85 14 EtO Me p-CN 3n 73 a General conditions: substrate 1 (1.0 mmol), substrate 2 (1.2 mmol), Pd(OAc)2 (2 mmol%), PPh3 (4 mmol%) and N(n-Bu)3 (2 mmol) in 5 mL of DMF at 130℃ for 24 h under argon. b Yield of the isolated product after flash column chromatography. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 2195
- HTML全文浏览量: 953


 下载:
下载:


 下载:
下载:

