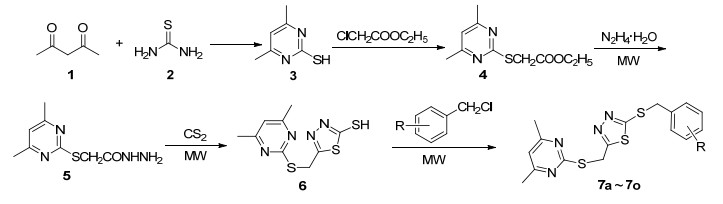
 图 图式1
新型含嘧啶环的1, 3, 4-噻二唑硫醚类化合物的合成
Figure 图式1.
Synthesis of novel 1, 3, 4-thiadiazole thioether derivatives containing pyrimidine moiety
图 图式1
新型含嘧啶环的1, 3, 4-噻二唑硫醚类化合物的合成
Figure 图式1.
Synthesis of novel 1, 3, 4-thiadiazole thioether derivatives containing pyrimidine moiety

Citation: Li Qianmei, Pang Kaisheng, Zhao Jianping, Liu Xinghai, Weng Jianquan. Synthesis and Biological Activity of Novel 1, 3, 4-Thiadiazole Thioether Derivatives Containing Pyrimidine Moiety[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 1009-1015. doi: 10.6023/cjoc201610026

新型含嘧啶环结构的1, 3, 4-噻二唑硫醚类化合物的合成及生物活性
-
关键词:
- 嘧啶环
- / 1, 3, 4-噻二唑
- / 硫醚
- / 微波合成
- / 杀菌活性
- / 抗杜氏利什曼原虫活性
English
Synthesis and Biological Activity of Novel 1, 3, 4-Thiadiazole Thioether Derivatives Containing Pyrimidine Moiety
-
含氮杂环化合物由于其类似生物体内生物碱结构, 具有对靶标专一性高、环境相容性好的特点, 已成为新药创制的主流研究领域[1].其中, 杂环结构中同时含有N和S元素的1, 3, 4-噻二唑是设计生物活性化合物的重要先导分子, 具有多种生物活性[2].大量研究表明, 1, 3, 4-噻二唑衍生物在农药领域具有除草[3]、杀虫[4]、杀菌[5, 6]和调节植物生长[7, 8]等生物活性, 特别是在杀菌剂领域, 目前已经成功开发的商品有噻菌茂、噻菌铜、噻唑锌、噻枯唑、噻唑菌胺、噻氟酰胺等. 1, 3, 4-噻二唑衍生物在医药领域具有抗癌[9]、抗炎[10]、抗糖尿病[11]、抗癫痫[12]、抗杜氏利什曼原虫[13]等活性.其中关于1, 3, 4-噻二唑类化合物的抗杜氏利什曼原虫活性的相关研究报道比较少, 而杜氏利什曼原虫主要寄生在人体肝、脾、骨髓、淋巴结等器官的巨噬细胞内, 对人体健康具有非常严重的危害, 病死率可达90%以上[14], 而目前相关治疗药物仍存在毒性较大、价格昂贵、易产生耐药性[15]等局限.因此开发新的抗杜氏利什曼原虫候选药物对于控制该病的蔓延具有重要意义.值得注意的是, 1, 3, 4-噻二唑衍生物中的“N—C—S”结构能够作为活性中心螯合生物体内的某些金属离子, 使其具有较好的细胞通透性, 容易被植物细胞和微菌孢吸收, 从而能够更好地发挥药效[16, 17]; 另一方面, 在噻二唑分子中引入不同活性基团及杂环骨架将会影响其生物活性, 并且可以明显增加其药性[18].毕竟单一杂环的生物活性在药物治疗过程中始终存在一定的限制, 如目前大多数噻二唑杀菌剂都只含一个1, 3, 4-噻二唑环, 所以有些表现出药效单一及抗药性[19]等问题, 但若在其分子内引入其它活性基团, 改善其生物活性, 那将得到更具应用价值的化合物.
在农用领域, 嘧啶类衍生物同样具有良好的杀虫[20]、杀菌[21]、除草[22, 23]、植物生长调节[24]等生物活性.而且嘧啶类化合物也能与金属离子形成配合物, 这不仅可以延长原药的活性及持效期, 还能降低对哺乳动物的毒性[25].据文献报道, 含嘧啶环结构的商品化农药应用已久, 仅杀菌剂就有乙嘧酚、甲基嘧菌胺、氟嘧菌酯等.此外, 研究表明在分子中通过供电子元素 (O, S) 同时连接两个或多个杂环活性中心, 即 (硫) 醚结构的引入, 有利于增强受体和配体之间的亲和力, 从而有效改善化合物的生物活性[26, 27].因此, 在新药物分子的设计过程中, 往往会在杂环结构中引入硫醚基团以提高其生物活性[28~30].
基于1, 3, 4-噻二唑、嘧啶环和硫醚结构的生物活性特征, 为了寻找具有良好生物活性的新型医药或农药先导化合物, 本工作采用活性亚结构拼接方法, 以硫脲和乙酰丙酮为起始原料合成了4, 6-二甲基嘧啶-2-硫醇, 再经过醚化、肼化、环化和苄基化反应将嘧啶环、1, 3, 4-噻二唑和硫醚等活性单元相互拼接, 设计合成了15个未见文献报道的含嘧啶环结构的1, 3, 4-噻二唑硫醚类化合物7a~7o.化合物结构经1H NMR, 13C NMR, IR, ESI-MS及元素分析表征确认.合成路线如Scheme 1所示.
 图 图式1
新型含嘧啶环的1, 3, 4-噻二唑硫醚类化合物的合成
Figure 图式1.
Synthesis of novel 1, 3, 4-thiadiazole thioether derivatives containing pyrimidine moiety
图 图式1
新型含嘧啶环的1, 3, 4-噻二唑硫醚类化合物的合成
Figure 图式1.
Synthesis of novel 1, 3, 4-thiadiazole thioether derivatives containing pyrimidine moiety
1 结果与讨论
1.1 合成及波谱数据
在中间体 (4, 6-二甲基嘧啶-2-硫基) 乙酰肼 (5) 和5-(4, 6-二甲基嘧啶-2-基硫代) 甲基-1, 3, 4-噻二唑-2-硫醇 (6) 的合成中, 比较了常规合成和微波辅助合成两种不同方法.采用常规方法合成, 中间体5需要加热回流12 h, 中间体6也需要在室温搅拌5 h完成环合, 但采用微波法只需在CEM Discover微波反应器中 (150 W, 1.4 MPa) 辐射反应10 min左右, 即可获得相当收率产品.可见, 采用微波辅助合成可大大缩短反应时间.
中间体5-(4, 6-二甲基嘧啶-2-基硫代) 甲基-1, 3, 4-噻二唑-2-硫醇 (6) 和取代苄氯在K2CO3存在下, 微波辐射 (150 W, 40 ℃, 1.4 MPa) 反应15 min即可得到目标化合物7; 反应速度快, 产物收率较高, 目标化合物7a~7o的收率在74.8 %~89.7 %之间.一般来说, 苯环上为吸电子基团取代 (R=卤素或氰基) 时, 化合物收率较给电子基团取代 (R=烷基或甲氧基) 时高.化合物结构均经1H NMR, 13C NMR, IR, ESI-MS及元素分析表征确认.从核磁氢谱数据中可以看出, 化合物7a~7o与嘧啶环相连的CH3的化学位移出现在δ 2.40~2.45, 为单重峰, 与1, 3, 4-噻二唑结构直接相连的CH2化学位移出现在δ 4.44~4.65, 为单重峰, 而苄位CH2的化学位移出现在δ 4.66~4.71, 也呈单峰.嘧啶环上氢的化学位移在δ 6.75~6.79, 为单重峰, 而苯环氢则出现在δ 6.93~7.72, 呈现多重峰; 从核磁碳谱中可以看出, 与嘧啶环相连的CH3的化学位移出现在δ 23.7, 与1, 3, 4-三唑结构直接相连的CH2出现在δ 29.4~29.5, 苄位CH2碳的化位移出现在δ 31.1~38.1, 嘧啶环上5位碳的化学位移在δ 115.9~116.4, 嘧啶环上4 (6) 位碳的化学位移出现在δ 164.8~167.6, 嘧啶环上2位碳的化学位移出现在δ 168.9~169.0, 而1, 3, 4-噻二唑环上5位碳的化学位移出现在δ 168.2~168.8, 1, 3, 4-噻二唑环上2位碳的化学位移则出现在δ 167.5~168.2.从红外光谱图中可以看出, 嘧啶环上的=C—H振动吸收峰出现在3060 cm-1附近, 与嘧啶环相连的CH3振动吸收峰出现在2990 cm-1附近, 1, 3, 4-噻二唑环中C=N伸缩振动吸收峰出现在1580 cm-1左右, 而嘧啶环上C=N或芳环C=C骨架振动吸收峰则出现在1535 cm-1附近, 并且C—S键在696 cm-1附近处也有一个较弱的振动吸收峰.另外, 化合物7k, 7l上的C≡N分别在2226, 2222 cm-1处有一个较强的振动吸收峰.在ESI-MS图谱中可以看出, 所有目标化合物均显示出了较强的分子离子峰[M+H]+.
1.2 目标化合物的杀菌活性
采用含药马铃薯琼脂培养基法 (PDA)[31]测试了目标化合物对真菌尖孢炭疽菌 (Colletrotichum acutatum)、枸杞炭疽病菌 (Colletrotichum gloeosporioides)、草莓炭疽病菌 (Colletrotichum fragariae)、灰葡萄球菌 (Botrytis cinerea) 和尖孢镰刀菌 (Fusarium oxysporum) 五种菌体的杀菌活性, 药剂质量浓度为50 μg/mL.以克菌丹 (captan) 和嘧菌酯 (Azoxystrobin) 为对照药剂, 测试结果见表 1, 并选择了活性最好的化合物7i进行了毒力测定, 测试结果见表 2.
 表 1
μg·mL-1浓度下目标化合物7a~7o的杀菌活性 (抑制率/%)
Table 1.
Fungicidal activities of compounds 7a~7o (inhibition rate/%) at 50μg·mL-1
表 1
μg·mL-1浓度下目标化合物7a~7o的杀菌活性 (抑制率/%)
Table 1.
Fungicidal activities of compounds 7a~7o (inhibition rate/%) at 50μg·mL-1
Compd. R C. acutatum C. gloeosporioides C. fragariae B. cinerea F. oxysporum CKa 0 0 0 0 0 Captan 98.10 87.40 97.30 95.20 87.70 Azoxystrobin 87.53 81.24 89.77 21.20 58.20 7a H 41.33 39.52 34.10 12.23 15.05 7b 2-Cl 48.50 37.40 51.46 0 0 7c 3-Cl 65.86 54.30 60.43 0 0 7d 4-Cl 43.03 46.56 41.12 0 0 7e 2, 4-Cl2 37.48 42.90 46.65 0 0 7f 3, 5-Cl2 48.35 38.08 41.00 0 0 7g 4-Br 44.46 40.65 49.08 0 0 7h 2-F 68.75 42.80 64.60 0 18.08 7i 3-F 79.84 57.03 73.46 17.47 22.03 7j 4-F 48.66 47.09 42.24 13.54 14.70 7k 3-CN 45.05 42.82 40.47 0 0 7l 4-CN 33.30 29.43 39.50 0 0 7m 3-CH3 24.73 26.50 27.77 0 0 7n 4-tert-Bu 40.36 8.82 26.08 0 0 7o 4-OCH3 22.57 12.35 27.44 0 0 a CK为空白对照. 表 1 μg·mL-1浓度下目标化合物7a~7o的杀菌活性 (抑制率/%)
Table 1. Fungicidal activities of compounds 7a~7o (inhibition rate/%) at 50μg·mL-1 表 2
化合物7i在48和72 h对尖孢炭疽菌和草莓炭疽菌的IC50 (μg·mL-1)
Table 2.
The IC50 values (μg·mL-1) of 7i against C. acutatum and C. fragariae at 48 and 72 h
表 2
化合物7i在48和72 h对尖孢炭疽菌和草莓炭疽菌的IC50 (μg·mL-1)
Table 2.
The IC50 values (μg·mL-1) of 7i against C. acutatum and C. fragariae at 48 and 72 h
Fungal isolate 7i Captan Azoxystrobin 48 h 72 h 48 h 72 h 48 h 72 h C. acutatum 3.0 6.3 2.5 5.2 2.9 6.8 C. fragariae 4.6 7.4 1.6 3.0 2.2 5.1 表 2 化合物7i在48和72 h对尖孢炭疽菌和草莓炭疽菌的IC50 (μg·mL-1)
Table 2. The IC50 values (μg·mL-1) of 7i against C. acutatum and C. fragariae at 48 and 72 h初步杀菌活性测试结果表明, 在50 μg/mL浓度下, 所有目标化合物对尖孢炭疽菌、枸杞炭疽菌和草莓炭疽菌均表现出一定的抑制活性, 但对灰葡萄球菌和尖孢镰刀菌基本没有抑制活性.部分化合物表现出中等抑菌活性, 如化合物7c, 7h和7i 对尖孢炭疽菌的抑制率均超过65%, 其中化合物7i对其抑制率达到79.84%;化合物7c和7i对枸杞炭疽菌的抑制率分别为54.30%和57.03%;化合物7c, 7h和7i 对草莓炭疽菌的抑制率均超过60%, 其中7i对其抑制率为73.46%.一般来说, 当在苯环上引入吸电子基团 (R=卤素或氰基) 时, 化合物活性较给电子基团取代时 (R=烷基或甲氧基) 要好, 且总体遵循吸电子能力越强活性越高的规律, 尤其是F原子的引入有助于化合物活性的提高, 如化合物7i对尖孢炭疽菌和草莓炭疽菌均表现出较好的抑制活性, 其抑制率分别为79.84%和73.46%, 72 h测试下的IC50值也较低, 分别为6.3和7.4.以上数据表明, 将嘧啶环、1, 3, 4-噻二唑和硫醚等活性单元相互拼接, 设计合成的目标化合物具有一定的抑菌活性, 若干化合物显示出了较好的抑菌活性, 具有进一步优化研究的价值.
1.3 目标化合物的抗杜氏利什曼原虫活性
采用溴化噻唑蓝四氮唑 (MTT) 法[32]对目标化合物7a~7o抑制杜氏利什曼原虫 (Leishmania donovani) 生长活性进行了筛选 (表 3).初步活性测试结果表明, 在40~1.6 μg/mL测试浓度下, 部分化合物表现出了一定的抗杜氏利什曼原虫活性, 其中化合物7h, 7i, 7j, 7n和7o的IC50值均低于30 μg/mL.含氟化合物7h, 7i和7j均具有良好的抗杜氏利什曼原虫活性, 其中化合物7h和7j的IC50值分别为21.3和23.6 μg/mL, 低于对照药剂巴龙霉素 (Paromomycin) (IC50=24.8 μg/mL), 说明苯环上F原子的引入对提高生物活性是有利的.进一步的结构优化与构效关系研究尚在进行中.
 表 3
目标化合物7a~7o的抗杜氏利什曼原虫活性[IC50/(μg· mL-1)]
Table 3.
Antileishmanial activities [IC50/(μg·mL-1)] of compounds 7a~7o
表 3
目标化合物7a~7o的抗杜氏利什曼原虫活性[IC50/(μg· mL-1)]
Table 3.
Antileishmanial activities [IC50/(μg·mL-1)] of compounds 7a~7o
Compd. R IC50 Paromomycin 24.8 7a H 31.8 7b 2-Cl >40.0 7c 3-Cl 30.6 7d 4-Cl >40.0 7e 2, 4-Cl2 >40.0 7f 3, 5-Cl2 >40.0 7g 4-Br 39.8 7h 2-F 21.3 7i 3-F 27.9 7j 4-F 23.6 7k 3-CN >40.0 7l 4-CN >40.0 7m 3-CH3 36.2 7n 4-tert-Bu 25.9 7o 4-OCH3 29.3 表 3 目标化合物7a~7o的抗杜氏利什曼原虫活性[IC50/(μg· mL-1)]
Table 3. Antileishmanial activities [IC50/(μg·mL-1)] of compounds 7a~7o2 结论
以硫脲和乙酰丙酮为起始原料合成4, 6-二甲基嘧啶-2-硫醇, 再经醚化、肼化、环化和苄基化反应, 合成了15个新型含嘧啶环结构的1, 3, 4-噻二唑硫醚类化合物.目标化合物结构经1H NMR, 13C NMR, IR, ESI-MS及元素分析表征确认.通过初步的生物活性试验, 发现部分化合物对尖孢炭疽菌、枸杞炭疽菌和草莓炭疽菌具有较好抑菌活性, 若干化合物还具有良好的抗杜氏利什曼原虫活性.同时, 还初步得到了一些有价值的构效关系信息, 为后续的化合物优化及结构改造奠定了基础.
3 实验部分
3.1 仪器与试剂
Bruker AVANCE Ⅲ 500 MHz核磁共振仪 (以CDCl3为溶剂, TMS为内标), Thermo-Finnigan LCQ Advantage质谱仪 (ESI), Carlo-Erba EA1110元素分析仪, Thermo Nicolet AVATAR 370傅立叶红外光谱仪, X-4型数字显示熔点测定仪 (温度计未校正), Discover CEM微波合成仪.本实验所用试剂均为市售分析纯.中间体4, 6-二甲基嘧啶-2-硫醇 (3) 参照文献[33]方法合成, 收率80.2%;化合物2-(4, 6-二甲基嘧啶-2-硫基) 乙酸乙酯 (4) 参照文献[34]方法合成, 收率95.0%.
3.2 实验方法
3.2.1 (4, 6-二甲基嘧啶-2-硫基) 乙酰肼 (5) 的合成
常规方法:将中间体2-(4, 6-二甲基嘧啶-2-硫基) 乙酸乙酯 (4) (6.86 g, 30 mmol) 和85%水合肼 (5.3 g, 90 mmol) 溶于60 mL无水乙醇中.升温至回流12 h.反应完毕, 减压脱溶得灰白色固体, 用石油醚-乙醇 (体积比3:1) 混合液洗涤, 干燥得白色固体 (4, 6-二甲基嘧啶-2-硫基) 乙酰肼 (5), 5.92 g, 收率92.0%. m.p. 84~85 ℃ (文献值[34] 84~86 ℃).
微波辅助:将2-(4, 6-二甲基嘧啶-2-硫基) 乙酸乙酯 (4) (686 mg, 3 mmol) 和85%水合肼 (530 mg, 9 mmol) 溶于2 mL无水乙醇.将反应管置于CEM Discover微波反应器 (150 W, 80 ℃, 1.4 MPa) 中反应10 min.经如上相同处理得白色固体591 mg, 收率91.9 %.
3.2.3 2-(取代苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7) 的合成
将6 (541 mg, 2 mmol)、取代苄氯 (2.10 mmol)、K2CO3 (304 mg, 2.20 mmol) 溶于8 mL乙醇中.将反应管置于CEM Discover微波反应器 (150 W, 40 ℃, 1.4 MPa) 中反应15 min.将上述反应液倒入冷水中析出固体, 抽滤、乙醇重结晶后干燥得到白色晶体, 即目标产物2-取代苄硫基-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7a~7o).
2-苄硫基-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7a):白色晶体, 收率84.3%. m.p. 54~55 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.40 (d, J=7.0 Hz, 2H), 7.33~7.30 (m, 2H), 7.29~7.25 (m, 1H), 6.78 (s, 1H), 4.71 (s, 2H), 4.53 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 168.9, 168.2, 167.5, 166.0, 135.9, 129.1, 128.6, 127.7, 116.3, 38.0, 29.4, 23.7; IR (KBr) ν: 3060, 2990, 2929, 1580, 1531, 1491, 1268, 1058, 846, 761, 698 cm-1; ESI-MS m/z: 361.5 [M+H]+. Anal. calcd for C16H16N4S3: C 53.30, H 4.47, N 15.54; found C 53.29, H 4.38, N 15.62.
2-(2-氯苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7b):白色晶体, 收率86.3%. m.p. 116~117 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.55~7.53 (m, 1H), 7.38~7.36 (m, 1H), 7.23~7.17 (m, 2H), 6.77 (s, 1H), 4.70 (s, 2H), 4.65 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.5, 168.2, 167.6, 138.3, 134.1, 129.7, 129.3, 128.6, 127.0, 116.4, 35.5, 29.4, 23.7; IR (KBr) ν: 3060, 2994, 2913, 1582, 1535, 1269, 1066, 853, 727, 665 cm-1; ESI-MS m/z: 395.56 [M+H]+. Anal. calcd for C16H15ClN4S3: C 48.66, H 3.83, N 14.19; found C 48.73, H 3.89, N 14.27.
2-(3-氯苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7c):白色晶体, 收率85.7%. m.p. 90~91 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.39 (s, 1H), 7.29~7.26 (m, 1H), 7.23~7.22 (m, 2H), 6.77 (s, 1H), 4.70 (s, 2H), 4.48 (s, 2H), 2.43 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.6, 167.7, 165.5, 138.2, 134.4, 129.9, 129.2, 128.0, 127.35, 116.4, 37.2, 29.4, 23.7; IR (KBr) ν: 3056, 2982, 2913, 1585, 1535, 1265, 1009, 869, 755, 696 cm-1; ESI-MS m/z: 395.3 [M+H]+. Anal. calcd for C16H15Cl-N4S3: C 48.66, H 3.83, N 14.19; found C 48.76, H 3.75, N 14.23.
2-(4-氯苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7d):白色晶体, 收率86.5%. m.p. 90~91 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.33 (d, J=8.5 Hz, 2H), 7.25 (d, J=8.5 Hz, 2H), 6.77 (s, 1H), 4.69 (s, 2H), 4.46 (s, 2H), 2.43 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.6, 167.5, 165.5, 134.7, 133.6, 130.5, 128.8, 116.4, 37.1, 29.4, 23.7; IR (KBr) ν: 3056, 2990, 2929, 1580, 1535, 1270, 1066, 808, 738, 645 cm-1; ESI-MS m/z: 395.3 [M+H]+. Anal. calcd for C16H15ClN4S3: C 48.66, H 3.83, N 14.19; found C 48.72, H 3.89, N 14.12.
2-(2, 4-二氯苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7e):白色晶体, 收率84.7%. m.p. 125~126 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.52 (d, J=8.5 Hz, 1H), 7.39 (d, J=2.5 Hz, 1H), 7.17 (dd, J=8.0, 2.0 Hz, 1H), 6.78 (s, 1H), 4.70 (s, 2H), 4.61 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.7, 167.6, 165.4, 135.0, 134.4, 132.9, 132.3, 129.5, 127.2, 116.4, 34.7, 29.4, 23.7; IR (KBr) ν: 3060, 2986, 2917, 1582, 1541, 1270, 1071, 846, 732, 647 cm-1. ESI-MS m/z: 429.0 [M+H]+. Anal. calcd for C16H14Cl2N4S3: C 44.75, H 3.29, N 13.05; found C 44.63, H 3.22, N 13.16.
2-(3, 5-二氯苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7f):白色晶体, 收率85.1%. m.p. 122~124 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.50 (d, J=2.0 Hz, 1H), 7.36 (d, J=8.5 Hz, 1H), 7.27~7.25 (m, 1H), 6.78 (s, 1H), 4.70 (s, 2H), 4.45 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3) δ: 168.9, 168.7, 167.6, 165.1, 136.6, 131.0, 130.5, 128.5, 116.4, 36.4, 29.4, 23.7; IR (KBr) ν: 3043, 2986, 2937, 1581, 1535, 1270, 1061, 890, 714, 649 cm-1; ESI-MS m/z: 429.0 [M+H]+. Anal. calcd for C16H14Cl2N4S3: C 44.75, H 3.29, N 13.05; found C 44.69, H 3.34, N 13.12.
2-(4-溴苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7g):白色晶体, 收率86.6%. m.p. 92~93 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.42 (d, J=8.5 Hz, 2H), 7.28 (d, J=6.0 Hz, 2H), 6.78 (s, 1H), 4.70 (s, 2H), 4.46 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.6, 167.6, 165.5, 135.3, 131.8, 130.8, 121.8, 116.4, 37.2, 29.4, 23.7; IR (KBr) ν: 3060, 2982, 2933, 1578, 1535, 1375, 1271, 1061, 890, 722, 649 cm-1; ESI-MS m/z: 438.45 [M+H]+. Anal. calcd for C16H15BrN4S3: C 43.73, H 3.44, N 12.75; found C 43.78, H 3.36, N 12.64.
2-(2-氟苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7h):白色晶体, 收率89.7%. m.p. 78~81 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.46 (td, J=7.5, 1.5 Hz, 1H), 7.26~7.22 (m, 1H), 7.08~7.01 (m, 2H), 6.77 (s, 1H), 4.70 (s, 2H), 4.55 (s, 2H), 2.43 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.5, 167.5, 165.8, 161.0 (d, J=246.2 Hz), 131.4 (d, J=3.4 Hz), 129.7 (d, J=8.1 Hz), 124.2 (d, J=3.6 Hz), 123.4 (d, J=14.5 Hz), 116.4, 115.5 (d, J=21.1 Hz), 31.1, 29.4, 23.7; IR (KBr) ν: 3060, 2984, 2894, 1585, 1529, 1381, 1271, 1057, 875, 764, 669 cm-1; ESI-MS m/z: 379.9 [M+H]+. Anal. calcd for C16H15F-N4S3: C 50.77, H 3.99, N 14.80; found C 50.63, H 4.15, N 14.84.
2-(3-氟苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7i):白色晶体, 收率86.3%. m.p. 71~73 ℃. 1H NMR (500 MHz, CDCl3) δ: 7.26~7.22 (m, 1H), 7.15 (d, J=7.5 Hz, 1H), 7.10 (d, J=9.5 Hz, 1H), 6.93 (td, J=8.5, 2.0 Hz, 1H), 6.79 (s, 1H), 4.69 (s, 2H), 4.48 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.5, 167.6, 165.5, 163.7, 162.7 (d, J=245.3 Hz), 138.6 (d, J=7.5 Hz), 130.1 (d, J=8.1 Hz), 124.8 (d, J=2.9 Hz), 116.0 (d, J=21.9 Hz), 115.9, 114.8 (d, J=21.0 Hz), 37.3, 29.4, 23.7; IR (KBr) ν: 3047, 2990, 2933, 1579, 1536, 1272, 1060, 898, 711, 677 cm-1; ESI-MS m/z: 379.7 [M+H]+. Anal. calcd for C16H15FN4S3: C 50.77, H 3.99, N 14.80; found C 50.64, H 3.89, N 14.76.
2-(4-氟苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7j):白色晶体, 收率89.2%. m.p. 95~96 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.33 (dd, J=8.5, 5.0 Hz, 2H), 6.93 (t, J=8.5 Hz, 2H), 6.76 (s, 1H), 4.66 (s, 2H), 4.44 (s, 2H), 2.40 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.5, 167.6, 165.7, 162.3 (d, J=245.1 Hz), 131.9 (d, J=3.1 Hz), 130.9 (d, J=8.1 Hz), 116.4, 115.5 (d, J=21.5 Hz), 37.2, 29.4, 23.7; IR (KBr) ν: 3051, 2991, 2949, 2921, 1584, 1509, 1272, 1063, 828, 730, 669 cm-1; ESI-MS m/z: 379.9 [M+H]+. Anal. calcd for C16H15FN4S3: C 50.77, H 3.99, N 14.80; found C 50.64, H 4.11, N 14.74.
2-(3-氰基苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7k):白色晶体, 收率84.7%. m.p. 127~128 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.72 (s, 1H), 7.68 (d, J=8.0 Hz, 1H), 7.55 (d, J=8.0 Hz, 1H), 7.42 (t, J=7.5 Hz, 1H), 6.79 (s, 1H), 4.70 (s, 2H), 4.54 (s, 2H), 2.45 (s, 6H); 13C NMR (125 MHz, CDCl3) δ: 169.0, 168.8, 167.6, 164.9, 138.2, 133.7, 132.5, 131.3, 129.4, 118.4, 116.5, 112.8, 36.5, 29.4, 23.7; IR (KBr) ν: 3060, 2994, 2917, 2226, 1580, 1534, 1272, 856, 712, 682 cm-1; ESI-MS m/z: 386.4 [M+H]+. Anal. calcd for C17H16N4S3: C 50.35, H 3.98, N 17.27; found C 50.23, H 3.86, N 17.31.
2-(4-氰基苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7l):白色晶体, 收率87.5%. m.p. 129~131 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.59 (d, J=8.5 Hz, 2H), 7.53 (d, J=8.5 Hz, 2H), 6.79 (s, 1H), 4.69 (s, 2H), 4.54 (s, 2H), 2.44 (s, 6H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 168.8, 167.6, 164.8, 142.0, 132.3, 129.9, 118.5, 116.4, 111.6, 36.9, 29.4, 23.7; IR (KBr) ν: 3064, 2982, 2925, 2222, 1580, 1532, 1271, 1063, 819, 763, 669 cm-1; ESI-MS m/z: 386.4 [M+H]+. Anal. calcd for C17H16N4S3: C 50.35, H 3.98, N 17.27; found C 50.28, H 3.87, N 17.31.
2-(3-甲基苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7m):白色晶体, 收率79.9%. m.p. 67~68 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.17~7.13 (m, 3H), 7.05~7.03 (m, 1H), 6.76 (s, 1H), 4.68 (s, 2H), 4.44 (s, 2H), 2.41 (s, 6H), 2.29 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 169.0, 168.2, 167.5, 166.2, 138.4, 135.7, 129.8, 128.6, 128.5, 126.2, 116.4, 38.1, 29.4, 23.7, 21.3; IR (KBr) ν: 3060, 2931, 2835, 1584, 1505, 838, 693 cm-1; ESI-MS m/z: 375.5 [M+H]+. Anal. calcd for C17H18N4S3: C 54.51, H 4.84, N 14.96; found C 54.46, H 4.78, N 15.07.
2-(4-叔丁基苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7n):白色晶体, 收率74.8%. m.p. 71~75 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.33 (s, 4H), 6.78 (s, 1H), 4.71 (s, 2H), 4.51 (s, 2H), 2.44 (s, 6H), 1.30 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 169.0, 168.2, 167.5, 166.4, 150.8, 132.7, 128.8, 125.6, 116.4, 37.7, 34.5, 31.2, 29.4, 23.7; IR (KBr) ν: 3060, 2982, 2913, 1587, 1531, 1271, 1057, 860, 780, 696 cm-1; ESI-MS m/z: 417.6 [M+H]+. Anal. calcd for C20H24N4S3: C 57.66, H 5.81, N 13.45; found C 57.53, H 5.98, N 13.64.
2-(4-甲氧基苄硫基)-5-(4, 6-二甲基嘧啶-2-甲硫基)-1, 3, 4-噻二唑 (7o):白色晶体, 收率80.1%. m.p. 83~84 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.29~7.27 (m, 2H), 6.80 (d, J=9.0 Hz, 2H), 6.75 (s, 1H), 4.68 (s, 2H), 4.44 (s, 2H), 3.75 (s, 3H), 2.41 (s, 6H); 13C NMR (125 MHz, CDCl3) δ: 169.0, 168.3, 167.6, 166.3, 159.2, 130.4, 127.8, 116.4, 114.1, 55.3, 37.7, 29.5, 23.7; IR (KBr) ν: 3060, 2965, 2863, 1582, 1533, 1372, 1264, 1059, 836, 758, 701 cm-1; ESI-MS m/z: 391.6 [M+H]+. Anal. calcd for C17H18N4OS3: C 52.28, H 4.65, N 14.35; found C 52.14, H 4.53, N 14.46.
辅助材料(Supporting Information)化合物6的1H NMR和化合物7a~7o的1H NMR, 13C NMR和IR, ESI-MS谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.2 5-(4, 6-二甲基嘧啶-2-基硫代) 甲基-1, 3, 4-噻二唑-2-硫醇6的合成
常规方法:将5 (6.37 g, 30 mmol) 加入到溶有KOH (2.60 g, 45 mmol) 的100 mL无水乙醇中, 再缓慢滴加CS2 (3.42 g, 45 mmol), 室温搅拌5 h后抽滤, 滤饼经乙醚洗涤, 干燥得到中间体.冰浴条件下将上述中间体加入到20 mL浓硫酸中, 搅拌2 h后, 将混合液倒入到冰水中, 析出白色固体, 抽滤得到的固体用10% NaOH溶液溶解, 滤去不容杂质, 得到的滤液用稀盐酸酸化到pH=4~5, 再次析出白色固体, 经抽滤、水洗、干燥得到5-(4, 6-二甲基嘧啶-2-基硫代) 甲基-1, 3, 4-噻二唑-2-硫醇 (6), 6.81 g, 收率84%. m.p. 171~172 ℃; 1H NMR (500 MHz, CDCl3) δ: 12.37 (s, 1H), 6.80 (s, 1H), 4.56 (d, J=143.5 Hz, 2H), 2.44 (s, 6H). Anal. calcd for C9H10N4S3: C 39.98, H 3.73, N 20.72; found 39.87, H 3.68, N 20.76.
微波辅助:将5 (425 mg, 2 mmol), KOH 168 mg, 3 mmol), CS2 (228 mg, 3 mmol) 溶于8 mL无水乙醇中.将反应管置于CEM Discover微波反应器 (150 W, 30 ℃, 1.4 MPa) 中反应12 min.经如上相同处理得4.78 g中间体6, 收率85.4%.
-
-
[1]
陈书哲, 硕士论文, 西北大学, 西安, 2008.Chen, S.-Z. M.S. Thesis, Northwest University, Xi'an, 2008 (in Chinese).
-
[2]
Kumar, D.; Kumar, N. M.; Noel, B.; Kavita, S. Eur. J. Med. Chem. 2012, 55, 432. doi: 10.1016/j.ejmech.2012.06.047
-
[3]
Wang, T.-T.; Miao, W.-K.; Wu, S.-S.; Bing, G.-F.; Zhang, X.; Qin, Z.-F.; Yu, H.-B.; Qin, X.; Fang, J.-X. Chin. J. Chem. 2011, 29, 959. doi: 10.1002/cjoc.201190196
-
[4]
韩峰, 万嵘, 王瑶, 王朋, 王锦堂, 有机化学, 2010, 30, 132. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338440.shtmlHan, F.; Wan, R.; Wang, Y.; Wang, P.; Wang, J.-T. Chin. J. Org. Chem. 2010, 30, 132 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338440.shtml
-
[5]
Zou, X.-J.; Lai, L.-H.; Jin, G.-Y.; Zhang, Z.-X. J. Argic. Food Chem. 2002, 50, 3757. doi: 10.1021/jf0201677
-
[6]
杨超, 杨松, 宋宝安, 胡德禹, 陈红军, 薛伟, 金林红, 吴剑, 徐维明, 柏松, 有机化学, 2010, 30, 1327. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339312.shtmlYang, C.; Yang, S.; Song, B.-A.; Hu, D.-Y.; Chen, H.-J.; Xue, W.; Jin, L.-H.; Wu, J.; Xu, W.-M.; Bai, S. Chin. J. Org. Chem. 2010, 30, 1327 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339312.shtml
-
[7]
宋新建, 王发松, 李世荣, 胡卫兵, 汪焱钢, 有机化学, 2011, 31, 572. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340019.shtmlSong, X.-J.; Wang, F.-S.; Li, S.-R.; Hu, W.-B.; Wang, Y.-G. Chin. J. Org. Chem. 2011, 31, 572 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340019.shtml
-
[8]
安悦, 魏魏, 牟萍萍, 贾金英, 吕建洲, 陈欣, 有机化学, 2010, 30, 1726. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339362.shtmlAn, Y.; Wei, W.; Mu, P.-P.; Jia, J.-Y.; Lü, J.-Z.; Chen, X. Chin. J. Org. Chem. 2010, 30, 1726 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339362.shtml
-
[9]
Terzioglu, N.; Gürsoy, A. Eur. J. Med. Chem. 2003, 38, 781. doi: 10.1016/S0223-5234(03)00138-7
-
[10]
Dekhane, D. V.; Pawar, S. S.; Gupta, S.; Shingare, M. S.; Patil, C. R.; Thore, S. N. Bioorg. Med. Chem. Lett. 2011, 21, 6527. doi: 10.1016/j.bmcl.2011.08.061
-
[11]
Mougenot, P.; Namane, C.; Fett, E.; Camy, F.; Dadji-Faïhun, R.; Langot, G.; Monseau, C.; Onofri, B.; Pacquet, F.; Pascal, C.; Crespin, O.; Ben-Hassine, M.; Ragot, J.-L.; Van-Pham, T.; Philippo, C.; Chatelsin-Egger, F.; Péron, P.; Bail, J. C. L.; Guillot, E.; Chsmiot-Clerc, P.; Chabanaud, M. A.; Pruniaux, M. P.; Schmidt, F.; Venier, O.; Nicolaï, E.; Viviani, F. Bioorg. Med. Chem. Lett. 2012, 22, 2497. doi: 10.1016/j.bmcl.2012.02.006
-
[12]
Harish, K. P.; Mohana, K. N.; Mallesha, L. Russ. J. Bioorg. Chem. 2014, 40, 97. doi: 10.1134/S1068162014010051
-
[13]
李英俊, 于洋, 靳焜, 高立信, 罗潼川, 盛丽, 邵昕, 李佳, 有机化学, 2015, 35, 129. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344629.shtmlLi, Y.-J.; Yu, Y.; Jin, K.; Gao, L.-X.; Luo, T.-C.; Sheng, L.; Shao, X.; Li, J. Chin. J. Org. Chem. 2015, 35, 129 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344629.shtml
-
[14]
宰文静, 将盼盼, 张新迎, Loiseau, M. P., 郭胜海, 范学森.有机化学, 2015, 35, 1335.Zai, W.-J.; Jiang, P.-P.; Loiseau, M. P.; Guo, H.-S.; Fan, X.-S. Chin. J. Org. Chem. 2015, 35, 1335 (in Chinese).
-
[15]
Minni. P.; Abedelmajeed, N.; Dmitry, K.; Marcel, K.; Jari, Y.; Kirsi, O.; Reto, B.; Charles, L. J.; Vania, M. M.; Sami, A. J. Nat Prod. 2016, 79, 362. doi: 10.1021/acs.jnatprod.5b00990
-
[16]
袁小勇, 张鹭, 韩小强, 周子原, 杜士杰, 万川, 杨冬燕, 覃兆海, 有机化学, 2014, 34, 170. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343556.shtmlYuan, X.-Y.; Zhang, L.; Han, X.-Q.; Zhou, Z.-Y.; Du, S.-J.; Wan, C.; Yang, D.-Y.; Tan, Z.-H. Chin. J. Org. Chem. 2014, 34, 170 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343556.shtml
-
[17]
李莎, 荆芬, 付小云, 赵继军, 王雪峰, 李宝林, 刘玉明, 陈宝泉, 有机化学, 2015, 35, 2624. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345198.shtmlLi, S.; Jing, F.; Fu, X.-Y.; Zhao, J.-J.; Wang, X.-F.; Li, B.-L.; Liu, Y.-M.; Chen, B.-Q. Chin. J. Org. Chem. 2015, 35, 2624 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345198.shtml
-
[18]
Patel, H.; Mishra, L.; Noolvi, M.; Karpoormath, R.; Cameotra, S. S. Arch. Pharm. Chem. Life Sci. 2014, 347, 668. doi: 10.1002/ardp.v347.9
-
[19]
张勇, 博士论文, 南京农业大学, 南京, 2011.Zhang, Y. Ph.D. Dissertation, Nanjing Agricultural University, Nanjing, 2011 (in Chinese).
-
[20]
尚尔才, 刘长令, 杜英娟, 化工进展, 1995, 5, 8. doi: 10.3321/j.issn:1000-6613.1995.05.001Shang, E.-C.; Liu, C.-L.; Du, Y.-J. Chem. Ind. Eng. Prog. 1995, 5, 8 (in Chinese). doi: 10.3321/j.issn:1000-6613.1995.05.001
-
[21]
吴琴, 宋宝安, 金林红, 胡德禹, 有机化学, 2009, 29, 365. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract326870.shtmlWu, Q.; Song, B.-A.; Jin, L.-H.; Hu, D.-Y. Chin. J. Org. Chem. 2009, 29, 365 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract326870.shtml
-
[22]
Bessard, Y.; Crettaz, Z. Tetrahedron 2000, 56, 4739. doi: 10.1016/S0040-4020(00)00390-2
-
[23]
Xu, H.; Pan, W. H.; Song, D. D.; Yang, G. G. J. Agric. Food Chem. 2007, 55, 9351. doi: 10.1021/jf0718345
-
[24]
Howe, K. R.; Shelton, R. B. J. Org. Chem. 1990, 55, 4603. doi: 10.1021/jo00302a025
-
[25]
白素贞, 娄新华, 尹桂玲, 山西化工, 2009, 29, 16. doi: 10.3969/j.issn.1004-7050.2009.01.006Bai, S.-Z.; Lou, X.-H.; Yin, G.-L. Shanxi Chem. Ind. 2009, 29, 16 (in Chinese). doi: 10.3969/j.issn.1004-7050.2009.01.006
-
[26]
Elway, A. H.; Abbas, A. A. Tetrahedron 2000, 56, 885 doi: 10.1016/S0040-4020(99)01068-6
-
[27]
Weng, J.-Q.; Liu, X.-H.; Huang, H.; Tan, C.-X.; Chen, J. Molecules 2012, 17, 989. doi: 10.3390/molecules17010989
-
[28]
刘刚, 刘春萍, 纪春暖, 孙琳, 温全武, 有机化学, 2008, 28, 525. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract331348.shtmlLiu, G.; Liu, C.-P.; Ji, C.-N.; Sun, L.; Wen, Q.-W. Chin. J. Org. Chem. 2008, 28, 525 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract331348.shtml
-
[29]
鲍小平, 刘军虎, 张峰, 邹林波, 蹇军友, 合成化学, 2013, 21, 200. doi: 10.3969/j.issn.1005-1511.2013.02.018Bao, X.-P.; Liu, J.-H.; Zhang, F.; Zou, L.-B.; Jian, J.-Y. Chin. J. Synth. Chem. 2013, 21, 200 (in Chinese). doi: 10.3969/j.issn.1005-1511.2013.02.018
-
[30]
阮铃莉, 范人杰, 刘幸海, 陈杰, 翁建全, 有机化学, 2015, 35, 1166.Run, L.-L.; Fan, R.-J.; Liu, X.-H.; Weng, J.-Q. Chin. J. Org. Chem. 2015, 35, 1166 (in Chinese).
-
[31]
Nikolas, F.; Charles, L. C.; Stephen, O. D.; Alexios, L. S.; David, E. W. J. Agric. Food Chem. 2006, 54, 1652.
-
[32]
Juan, R. L.; Luis, J. C.; Fernando, A.; Luis, R. Mol. Pharm. 2010, 7, 1609.
-
[33]
Goswami, S.; Jana, S.; Dey, S.; Adak, A. K. Aust. J. Chem. 2007, 60, 120. doi: 10.1071/CH06388
-
[34]
张刚, 高光宇, 李清寒, 杨学军, 化学试剂, 2014, 36, 594.Zhang, G.; Gao, G.-Y.; Li, Q.-H.; Yang, X.-J. Chem. Reag. 2014, 36, 594 (in Chinese).
-
[1]
-
表 1 μg·mL-1浓度下目标化合物7a~7o的杀菌活性 (抑制率/%)
Table 1. Fungicidal activities of compounds 7a~7o (inhibition rate/%) at 50μg·mL-1
Compd. R C. acutatum C. gloeosporioides C. fragariae B. cinerea F. oxysporum CKa 0 0 0 0 0 Captan 98.10 87.40 97.30 95.20 87.70 Azoxystrobin 87.53 81.24 89.77 21.20 58.20 7a H 41.33 39.52 34.10 12.23 15.05 7b 2-Cl 48.50 37.40 51.46 0 0 7c 3-Cl 65.86 54.30 60.43 0 0 7d 4-Cl 43.03 46.56 41.12 0 0 7e 2, 4-Cl2 37.48 42.90 46.65 0 0 7f 3, 5-Cl2 48.35 38.08 41.00 0 0 7g 4-Br 44.46 40.65 49.08 0 0 7h 2-F 68.75 42.80 64.60 0 18.08 7i 3-F 79.84 57.03 73.46 17.47 22.03 7j 4-F 48.66 47.09 42.24 13.54 14.70 7k 3-CN 45.05 42.82 40.47 0 0 7l 4-CN 33.30 29.43 39.50 0 0 7m 3-CH3 24.73 26.50 27.77 0 0 7n 4-tert-Bu 40.36 8.82 26.08 0 0 7o 4-OCH3 22.57 12.35 27.44 0 0 a CK为空白对照. 表 2 化合物7i在48和72 h对尖孢炭疽菌和草莓炭疽菌的IC50 (μg·mL-1)
Table 2. The IC50 values (μg·mL-1) of 7i against C. acutatum and C. fragariae at 48 and 72 h
Fungal isolate 7i Captan Azoxystrobin 48 h 72 h 48 h 72 h 48 h 72 h C. acutatum 3.0 6.3 2.5 5.2 2.9 6.8 C. fragariae 4.6 7.4 1.6 3.0 2.2 5.1 表 3 目标化合物7a~7o的抗杜氏利什曼原虫活性[IC50/(μg· mL-1)]
Table 3. Antileishmanial activities [IC50/(μg·mL-1)] of compounds 7a~7o
Compd. R IC50 Paromomycin 24.8 7a H 31.8 7b 2-Cl >40.0 7c 3-Cl 30.6 7d 4-Cl >40.0 7e 2, 4-Cl2 >40.0 7f 3, 5-Cl2 >40.0 7g 4-Br 39.8 7h 2-F 21.3 7i 3-F 27.9 7j 4-F 23.6 7k 3-CN >40.0 7l 4-CN >40.0 7m 3-CH3 36.2 7n 4-tert-Bu 25.9 7o 4-OCH3 29.3 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 13
- 文章访问数: 1438
- HTML全文浏览量: 181


 下载:
下载:
 下载:
下载:

