 图1
海洋异壁放线菌A. cyanogriseus WH1-2216-6非浅蓝霉素类发酵粗提物的HPLC-UV分析图
Figure1.
HPLC profile of non-caerulomycin containing fraction from the marine-derived A. cyanogriseus WH1-2216-6
图1
海洋异壁放线菌A. cyanogriseus WH1-2216-6非浅蓝霉素类发酵粗提物的HPLC-UV分析图
Figure1.
HPLC profile of non-caerulomycin containing fraction from the marine-derived A. cyanogriseus WH1-2216-6

Citation: Mei Xiangui, Wang Liping, Wang Dongyang, Fan Jie, Zhu Weiming. Polycyclic Tetramate Macrolactams from the Marine-Derived Actinoalloteichus cyanogriseus WH1-2216-6[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2352-2360. doi: 10.6023/cjoc201703048

海洋异壁放线菌WH1-2216-6产生的多环含特特拉姆酸大环内酰胺
-
关键词:
- 异壁放线菌
- / 5, 5, 6-多环含特特拉姆酸大环内酰胺
- / 抗肿瘤活性
- / 抗烟曲霉活性
English
Polycyclic Tetramate Macrolactams from the Marine-Derived Actinoalloteichus cyanogriseus WH1-2216-6
-
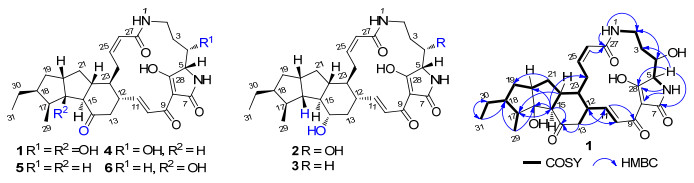
含氮化合物是药物的主要形式, 也是海洋微生物天然产物的主要结构类型[1].多环含特特拉姆酸大环内酰胺类似物(Polycyclic tetramate macrolactams, PTMs)是一类来自微生物或海绵的、具有良好生物活性的天然产物.顾名思义, PTMs类化合物含有一个特特拉姆酸结构单元、一个稠合的多骈环体系和一个大环内酰胺内核, 5, 5, 6-、5, 6, 5-、5, 5-和5, 4, 6-环是四种常见的多骈环体系[2, 3].来自链霉菌Streptomyces phaeochromogenes var. ikaruganensis的斑鸠霉素(Ikarugamycin)是首个PTMs类似物[4], 随后一系列类似物先后从微生物或海绵中分离报道[5~8], 目前共报道了46个PTMs天然产物[3], 其中17个为5, 5, 6-PTMs. 1991年报道了首个5, 5, 6-PTMs, 即discodermide(分离自海绵Discodermia dissolute)[5], 随后是maltophilin (4)[7]、dihydromaltophilin[8]或HSAF (2)[9]、xanthobaccins A, B和C(5)[10]、frontalamides A, B, FI-1, FI-2 (6)和FI-3[2]、4-dehydroxy HSAF (3)[11]、lysobacteramide B[12]以及pactamides A, B, D和F[13].这些5, 5, 6-PTMs天然产物表现出抗细菌[7]、抗真菌[9, 14, 15]和肿瘤细胞毒活性(A549、HepG2和MCF-7[12]以及SF-268、NCI-H460和Hep-G2[13]).化合物HSAF只抑制丝状真菌, 对哺乳动物和植物不起作用, 有望成为新一代杀菌剂或抗真菌药物[14~17].因此, PTMs成为化学家、生物学家和药物学家关注的热点[2, 9, 18, 19].
Actinoalloteichus cyanogriseus WH1-2216-6是本课题组从海底沉积物中分离鉴定的一株海洋异壁放线菌[20], 该菌生产浅蓝霉素类天然产物.为了提高浅蓝霉素的产量, 我们优化了该菌株的发酵条件, 将浅蓝霉素A的发酵效价提高了7倍[21].在累积完浅蓝霉素类化合物后, 对剩余组分进行了HPLC检测, 发现在λmax 219和322 nm附近存在PTMs类的特征紫外吸收(图 1).于是采用HPLC-UV追踪的方式对其分离纯化, 获得了6个PTMs类化合物1~6; 通过高分辨质谱(HRESIMS)、一维(1D)和二维核磁共振光谱(2DNMR)、圆二色谱(CD)等结构测定方法, 将化合物1~6的结构分别鉴定为16-hydroxymaltophilin (1)、dihydromaltophilin或HSAF(2)[8, 9]、4-deoxyHSAF或4-deoxydihydromaltophilin (3)[11]、maltophilin (4)[7]、xanthobaccin C (5)[10]和30, 31-dihydrofrontalamide A或FI-2 (6)[2], 其中化合物1为新化合物.新化合物1对人癌细胞株具有中等抑制活性和较好的选择性, 其抑制BXPC-3、HCT-116、Jurkat、PANC-1、A549和MCF-7人癌细胞的IC50值以及人正常的肝癌细胞L-02的CC50值分别为4.5、5.7、7.5、7.9、9.5、9.7和235.9 μmol·L-1, 选择指数(SI)分别为52.4、41.1、31.5、29.9、24.8和24.3.
 图1
海洋异壁放线菌A. cyanogriseus WH1-2216-6非浅蓝霉素类发酵粗提物的HPLC-UV分析图
Figure1.
HPLC profile of non-caerulomycin containing fraction from the marine-derived A. cyanogriseus WH1-2216-6
图1
海洋异壁放线菌A. cyanogriseus WH1-2216-6非浅蓝霉素类发酵粗提物的HPLC-UV分析图
Figure1.
HPLC profile of non-caerulomycin containing fraction from the marine-derived A. cyanogriseus WH1-2216-6
1 结果与讨论
化合物1, 浅红色粉末, 微溶于甲醇, 易溶于DMSO, 紫外光谱在λmax [log ε/(L·mol-1·cm-1)] 210 (3.99) 和326 (3.55) nm处有PTMs的特征吸收[2].高分辨质谱中m/z 527.2747处为准分子离子峰[M+H]+(calcd for C29H39N2O7, 527.2752), 相应于分子式C29H38N2O7.其13C NMR、DEPT和HMQC给出29个碳信号, 包括2个甲基信号、7个亚甲基信号、13个次甲基信号(含4个为烯属次甲基、1个连氧次甲基)、7个季碳信号(5个羰基或烯醇季碳、1个连氧季碳和1个烯属季碳); 而δC/H 122.1/6.88 (C-10)、147.4/6.60 (C-11) 和138.2/5.96 (C-25)、124.5/5.75 (C-26) 以及偶合常数J10, 11=15.6 Hz和J25, 26=11.3 Hz表明分子中存在两对对称二取代的双键, 且构型为10E和25Z (表 1).这些NMR数据与比之少一个氧的5, 5, 6-PTMs类化合物maltophilin (4)[7]和FI-2 (6)[2]很相似, 进一步表明其为5, 5, 6-PTMs类化合物.仔细比较发现, 除C-14~C-21和C-29的化学位移明显不同外, 其它碳的化学位移与maltophilin一致或相近; 而除C-2~C-5和C-28之外, 其它碳的化学位与FI-2(6)一致或相近.表明化合物1是16-羟基取代的maltophilin或4-羟基取代的FI-2. 1H-1H COSY给出NH-1 (δH 7.99)/H-2 (δH3.24~3.27 & 2.56~2.62)/H-3 (δH 1.38~1.43 & 1.17~1.24)/H-4 (δH 3.80~3.84)/H-5 (δH 3.87)/NH-6 (δH8.95) 之间的相关信号, 而与化合物4相比, H-15/H-16/ H-17之间的1H-1H COSY信号中断(图 2), NH-6与C-8 (δC 100.7)/C-28 (δC 193.0)、H-5与C-7 (δC 175.6)/C-28、H-13 (δH 2.56~2.62 & 2.10~2.14) 与C-11 (δC 147.4)、H-22 (δH 2.01~2.05) 与C-23 (δC 43.0) 以及H-15 (δH 2.32) 和H-29 (δH 0.94) 与C-16 (δC 89.7) 之间的关键HMBC进一步确定化合物1为16-hydroxy-maltophilin或4-hydroxy FI-2.化合物1与化合物2~6具有相同的比旋光方向、相同的圆二色谱(ECD)卡顿(Cotton)效应, 在λmax220~330 nm短波到长波方向出现正、负、正Cotton效应:λmax [Δε/(L·mol-1·cm-1)] 221 (+3.2), 249 (-3.8), 328 (+1.7) nm; 表明其4-、5-、12-、15-、16-、17-、18-、20-、22-和23-位手性中心的绝对构型相同, 即(4S, 5S, 12R, 15R, 16R, 17S, 18S, 20R, 22R, 23S)-.
 表 1
化合物1的1H NMR (500 MHz)和13C NMR (125 MHz)数据(DMSO-d6)
Table 1.
1H NMR (500 MHz) and 13C NMR (125 MHz) data for compound 1 (DMSO-d6)
表 1
化合物1的1H NMR (500 MHz)和13C NMR (125 MHz)数据(DMSO-d6)
Table 1.
1H NMR (500 MHz) and 13C NMR (125 MHz) data for compound 1 (DMSO-d6)
Position δC δH(J in Hz) Position δC δH(J in Hz) 1-NH 7.99, t (5.8) 17 49.3, CH 1.17~1.24, m 2 36.4, CH2 3.24~3.27, m; 2.56~2.62, m 18 50.4, CH 1.48~1.55, m 3 31.0, CH2 1.38~1.43, m; 1.17~1.24, m 19 38.1, CH2 2.01~2.05, m; 0.68, q like (12.5) 4 70.1, CH 3.80~3.84, m 20 47.9, CH 2.56~2.62, m 5 68.6, CH 3.87, s 21 36.5, CH2 2.10~2.14, m; 0.96~1.03, m 6-NH 8.95, s 22 51.3, CH 2.01~2.05, m 7 175.6, C 23 43.0, CH 1.84~1.91, m 8 100.7, C 24 27.4, CH2 3.61~3.69, m; 2.01~2.05, m 9 171.9, C 25 138.2, CH 5.96, t (11.3) 10 122.1, CH 6.88, d (15.6) 26 124.5, CH 5.75, dd (11.3, 3.5) 11 147.4, CH 6.60, dd (15.6, 10.4) 27 165.5, C 12 47.1, CH 2.40~2.48, m 28 193.0, C 13 46.0, CH2 2.56~2.62, m; 2.10~2.14, m 29 11.5, CH3 0.94, d (6.4) 14 210.1, C 30 25.3, CH2 1.48~1.55, m; 0.96~1.03, m 15 64.2, CH 2.32, d (13.0) 31 12.0, CH3 0.84, t (7.3) 16 89.7, C 化合物2~6的构造和相对构型系通过与文献值比较NMR数据(表S1~S2)而确定(具有相同或非常相近的1H和13C NMR数据)[2, 7, 8, 11], 其绝对构型则进一步通过比旋光和ECD而确定的.其中化合物2和3与文献中的dihydromaltophilin或HSAF和4-deoxyHSAF[12]具有相近的ECD曲线(图S14), 化合物6与文献中的30, 31-dihydrofrontalamide A或FI-2[2]具有相同的比旋光方向([α]D+50 vs+96).文献中没有报道化合物4和5的比旋光和ECD数据, 但我们发现其在λmax220~330 nm与化合物2和3具有相同的ECD曲线和Cotton效应, 表明它们具有相同的绝对构型.另外, 本文还首次报道了化合物5的NMR数据.
 表 2
化合物1~5的细胞毒活性[IC50或CC50/(μmol·L-1)]和选择指数(SI=CC50/IC50)
Table 2.
Cytotoxicities [IC50 or CC50/(μmol·L-1)] and selection indexes (SI=CC50/IC50) of compounds 1~5
表 2
化合物1~5的细胞毒活性[IC50或CC50/(μmol·L-1)]和选择指数(SI=CC50/IC50)
Table 2.
Cytotoxicities [IC50 or CC50/(μmol·L-1)] and selection indexes (SI=CC50/IC50) of compounds 1~5
Cell line 1 2 3 4 5 Adriamycin A549 9.5/24.8 0.3/9.3 0.9/1.6 3.6/4.5 >10/- 1.3/0.31 K562 >10/- 4.9/0.6 5.7/0.2 >10/- >10/- 0.3/1.33 MCF-7 9.7/24.3 0.1/28.0 0.4/3.5 3.3/4.9 3.4/4.3 1.0/0.4 HCT-116 5.7/41.4 2.9/1.0 2.9/0.5 4.4/3.7 4.6/3.2 0.2/2.0 Jurkat 7.5/31.5 1.7/1.6 1.4/1.0 1.9/8.5 6.7/2.2 0.4/1.0 PANC-1 7.9/29.9 2.1/1.3 2.3/0.6 5.4/3.0 7.0/2.1 1.0/0.4 BXPC-3 4.5/52.4 4.3/0.7 2.9/0.5 4.1/3.9 4.0/3.6 0.7/0.6 L-02a 235.9 2.8 1.4 16.1 14.5 0.4 采用噻唑蓝(MTT)和磺酰罗丹明B (Sulforhodamine B, SRB)比色法测定了化合物1~5对人肺癌细胞(A549)、乳腺癌细胞(MCF-7)、结肠癌细胞(HCT-116)、胰腺癌细胞(PANC-1和BXPC-3)、慢性髓原白血病细胞(K562) 和急性T淋巴细胞白血病细胞(Jurkat)以及人正常肝细胞(L-02) 的增殖抑制活性, 并计算相应的选择指数(SI).结果(表 2)表明:化合物1~5对7株人癌细胞株具有良好的细胞增殖抑制活性, 半数抑制浓度(IC50)在0.1~9.5 μmol·L-1, 其中化合物2活性最好.尽管新化合物1肿瘤细胞增殖活性相对较差, 但其对人体正常肝细胞毒性较低(CC50为235.9 μmol·L-1), 对HCT-116、Jurkat和BXPC-3三株细胞系的选择指数分别高达41.4、31.5和52.4, 具有成为低毒抗肿瘤药物先导物的潜力.除化合物2和3对A549和MCF-7的活性报道外[2], 尚无化合物1~5对这些人癌细胞株活性的报道.
另外, 我们还采用微量比浊法(96孔板)测试了化合物1~6的抗烟曲霉(Aspergillus fumigates AF293) 活性, 结果显示化合物1和6在50 μg/mL测试浓度下未检测到抑制活性, 而化合物2~5具有一定的抗烟曲霉活性, 最小抑制浓度(MIC)在1.5625~25.0 μg/mL之间.其中化合物2活性最佳, MIC为1.56 μg/mL即3.04 μmol· L-1, 与阳性药依曲康唑相当(MIC为1.25 μg/mL即1.77 μmol·L-1); 其次是化合物4, MIC为3.125 μg/mL即6.12 μmol·L-1.这是首次发现5, 5, 6-PTMs类化合物具有抗烟曲霉活性, 为抗烟曲霉药物的筛选提供了新的结构类型.
 表 3
化合物1~6的抗烟曲霉(A. fumigatus AF 293) 活性[MIC/(μg·mL-1)]
Table 3.
Antifungal activity of compounds 1~6 against Aspergillus fumigatus AF293 [MIC/(μg·mL-1)]
表 3
化合物1~6的抗烟曲霉(A. fumigatus AF 293) 活性[MIC/(μg·mL-1)]
Table 3.
Antifungal activity of compounds 1~6 against Aspergillus fumigatus AF293 [MIC/(μg·mL-1)]
Compd. 50 25 12.5 6.25 3.125 1.5625 0.78125 1 - - - - - 2 + + + + + + - 3 + + - - - 4 + + + + + - - 5 + + - - - 6 - - - - - a+Tested with obvious inhibition activity; b-tested without observed inhibition activity. 化合物2最早于1997年分离自印第安娜土壤链霉菌Streptomyces sp., 并命名为dihydromaltophilin, 具有抗葡萄霜霉病致病菌Plasmopara viticola活性[8], 由于该化合物既耐高温又具有抗真菌活性, 也被命名为热稳定抗真菌因子(Heat Stable Antifungal Factor, HSAF)[9].化合物3于2012年分离自一株敲出固醇脱氢酶(SD)基因的产酶溶杆菌Lysobacter enzymogenes突变株[11], 由于SD基因的敲出使得化合物3大量积累、不再产生HSAF, 化合物3丧失了抑制棒色青霉(Penicillium avellaneum)的活性; 本文结果也表明:化合物2具有强抗烟曲霉A. fumigates AF29活性, 而无3-OH的化合物3没有活性; 表明3-OH在该类化合物抗菌活性中具有重要作用.化合物4最早发现于1996年, 从油菜根瘤菌——窄食嗜麦芽单胞菌(Stenotvophomonas maltophilia R3089) 的发酵产物中分离得到, 可以抑制各种腐生菌生长, 包括人类和植物病原真菌, 但对所测试的革兰氏阳性和阴性细菌却无明显活性[7]; 本文结果显示化合物4也具有较强的抗烟曲霉A. fumigates AF29活性(MIC为3.12 μg/mL), 但抗烟曲霉活性不及化合物2, 表明14-位羰基也是该类化合物抗真菌活性的重要基团, 但被还原为14-OH后的抗真菌活性进一步加强.化合物5首次分离自一种甜菜根瘤菌——嗜麦芽寡养单胞菌Stenotrophomonas sp. SB-K88的发酵产物中, 有抗真菌活性[10], 但没有NMR数据.本文首次报道了化合物5的NMR数据; 化合物6来自一株链霉菌Streptomyces sp. SPB78的突变株, 为frontalamide生物合成中的中间产物[2].化合物1和6未显示抗烟曲霉活性, 表明16-OH的存在减弱5, 5, 6-PTMs类化合物的抗真菌活性的.也有一篇文献报道5, 6, 5-PTMs类的化合物28-N-methylikaru-gamycin、isoikarugamycin和ikarugamycin的抗烟曲霉活性[22], 但活性不及5, 5, 6-PTMs类的化合物2和4.
2 结论
从海洋异壁放线菌(A. cyanogriseus WH1-2216-6) 的发酵产物中分离鉴定了1个新的5, 5, 6-多环含特特拉姆酸大环内酰胺类化合物16-hydroxymaltophilin (1)以及5个结构类似物dihydromaltophilin (2)、4-deoxydihy-dromaltophilin (3)、maltophilin (4)、xanthobaccin C (5)和30, 31-dihydrofrontalamide A (6).首次发现dihydro-maltophilin (2)和maltophilin (4)具有较强的抗烟曲霉A. fumigates AF29活性, 其中化合物2的活性与阳性药伊曲康唑相当.除化合物2和3对A549和MCF-7的活性外, 还首次报道了化合物1~4对A549、化合物2和3对K562以及化合物1~5对MCF-7、HCT-116、Jurkat、PANC-1和BXPC-3人癌细胞株的增殖抑制活性.新化合物1对几株人癌细胞株表现出中等细胞毒活性和较好的选择性, 选择指数(SI)为24~52, 表明5, 5, 6-PTMs类化合物中4-位与14-位的羟基取代(如化合物1、2、4)有利于增强其肿瘤细胞毒活性和抗烟曲霉活性, 而16-位的羟基取代(如化合物1、6)则减弱其对正常细胞的毒性和抗烟曲霉活性、增加对肿瘤细胞的选择性.
3 实验部分
3.1 仪器与试剂
核磁共振波谱仪为德国Bruker公司Avance 500型; 质谱仪为Waters公司Micromass EI-4000 (Autospec-Ultima-TOF)型或Q-TOF ULTIMA GLOBAL GAA076 LC型; 双光束分光光度计为日本Hitachi日立公司UH5300型; 红外光谱仪为美国NICOLET公司NEXUS 470FT-IR型; 旋光仪为日本JASCO公司P-1020型; 圆二色谱仪为日本JASCO分光株式会社J-815型; 分析用高效液相色谱仪为美国Waters公司(Waters1525泵, Waters 2996二极管阵列检测器, Empower Ⅲ工作站, YMC-Pack ODS-A柱: 5 μm, 4.6 mm×250 mm); 半制备高效液相色谱仪为美国Waters公司(Waters 1525泵, Waters2487紫外检测器, Breeze工作站, YMC-Pack ODS-A柱: 5 μm, 10×250 mm); 旋转蒸发仪为EYELA公司N-1100型; 实验所用柱色谱硅胶及薄层色谱硅胶板购自青岛海洋化工厂; 凝胶为GE Healthcare公司SephadexTM LH-20型; 其他所用试剂均为国产或进口分析纯.
3.2 实验方法
3.2.1 发酵提取
海洋异壁放线菌(Actinoalloteichus cyanogriseus WH1-2216-6) 分离自山东威海海域的潮间带海泥样品并保藏于中国典型培养物保藏中心[20].该菌株形态学特征如下(高氏Ⅰ号培养基):菌株生长较为缓慢, 生长10~15 d后, 菌丝呈现灰白色, 并且产生水溶性的蓝紫色色素(图 1); 显微形态显示其气生菌丝断裂为孢子, 孢子丝直, 并且呈灰绿色.
发酵培养:按照以前获得优化培养条件[21], 将生长良好的海洋异壁放线菌(A. cyanogriseus WH1-2216-6) 成熟孢子接种在发酵液体培养基中(组分: 20 g可溶性淀粉、20 g蛋白胨、2 g碳酸钙、20 g甘油、0.4 g 2-吡啶甲酸、50 g XAD-16大孔吸附树脂、1 L陈海水, pH=7.5), 500 mL摇瓶中培养基的装液量为150 mL, 于28 ℃恒温、180 r/min摇床培养12 d, 共计发酵约40 L, 发酵液采用等量乙酸乙酯萃取三遍, 得粗提物约118.5 g.
3.2.2 分离鉴定
向每克粗提物中加入50 mL的3%的HCl溶液, 搅拌, 静置, 用等体积二氯甲烷萃取三次, 水相用氨水调节至pH=8.0, 再用二氯甲烷萃取, 浓缩有机相得35.0 g生物碱部分, 所述生物碱部分用减压硅胶柱色谱分离(VLC, 7 cm×20 cm), 依次以石油醚、二氯甲烷、二氯甲烷-甲醇(V: V=100: 1, 50: 1, 25: 1, 15: 1, 10: 1, 5: 1, 4: 1, 2: 1, 1: 1, 0: 1) 为溶剂进行梯度洗脱分为12个组分Fr.1~Fr.12, 其中V(二氯甲烷): V(甲醇)=5: 1洗脱组分Fr.8和V(二氯甲烷): V(甲醇)=4: 1洗脱组分Fr.9在HPLC-UV检测中具有PTMs类化合物的特征UV吸收. Fr.8 (85 mg)经反相硅胶柱色谱分离(VLC, RP-18, 40~63 μm, 3.5 cm×30 cm), 以V(甲醇): V(1.5‰三氟乙酸水溶液)=70: 30洗脱, 得到化合物6 (9.5 mg, 保留时间tR 18.9 min); Fr.9 (650 mg)经Sephadex LH-20凝胶柱色谱(2.5×150 cm)分离、甲醇洗脱得到10个组分: Fr.9-1~Fr.9-10, 所得组分Fr.9-7 (180 mg)再经半制备HPLC分离(ODS-A柱, V(甲醇): V(1.5‰三氟乙酸水溶液)=75: 25) 纯化得到化合物1 (15.0 mg, 保留时间tR 9.7 min)、2 (24.0 mg, 保留时间tR 14.4 min)、3 (8.2 mg, 保留时间tR 16.2 min)、4 (25.0 mg, 保留时间tR 19.2 min)和5 (5.0 mg, 保留时间tR 26.4 min).
16-Hydroxymaltophilin (1):浅红色无定型粉末. [α]D21+20 (c 0.15, CH3OH), [α]D18+59 (c 0.21, CH3OH-CHCl39: 1); UV (CH3OH) λmax [log ε/(L·mol-1·cm-1)]: 210 (3.99), 326 (3.55) nm; ECD (c 0.05, CH3OH) λmax [Δε/(L·mol-1·cm-1)]: 221 (+3.2), 249 (-3.8), 328 (+1.7) nm; 1H NMR及13C NMR数据见表 1; IR (KBr) νmax: 3589, 3570, 3535, 3483, 3402, 3205, 2915, 2846, 1655, 1637, 1509, 1474, 1024, 889 cm-1. HRESIMS calcd for C29H39N2O7 [M+H]+ 527.2752, found 527.2747
Dihydromaltophilin (2):浅红色无定型粉末. [α]D21+21 (c 0.15, CH3OH), [α]D18+61 (c 0.21, CH3OH-CHCl39: 1); UV (CH3OH) λmax [log ε/(L·mol-1·cm-1)]: 212 (4.29), 314 (3.99) nm; ECD (c 0.05, CH3OH) λmax [Δε/(L·mol-1·cm-1)]: 221 (+10.7), 249 (-15.0), 328 (+5.2) nm; 1H NMR (500 MHz, DMSO-d6) δ:8.88 (s, 1H, 6-NH), 7.95 (t, J=6.0 Hz, 1H, NH-1), 6.86 (d, J=15.4 Hz, 1H, CH-10), 6.56 (dd, J=15.4, 10.4 Hz, 1H, CH-11), 5.90 (t, J=11.3 Hz, 1H, CH-25), 5.70 (d, J=11.3 Hz, 1H, CH-26), 3.86 (s, 1H, CH-5), 3.79~3.83 (m, 1H, CH-4), 3.47~3.55 (m, 1H, CH2-24a), 3.22~3.27 (m, 1H, CH2-2a), 3.21~3.28 (m, 1H, CH-14), 2.53~2.61 (m, 1H, CH2-2b), 2.29~2.39 (m, 1H, CH-20), 1.98~2.06 (m, 1H, CH2-21a), 1.98~2.06 (m, 1H, CH-12), 1.98~2.06 (m, 1H, CH2-19a), 1.85~1.92 (m, 1H, CH2-24b), 1.72~1.78 (m, 1H, CH-16), 1.71~1.77 (m, 1H, CH2-13a), 1.60~1.67 (m, 1H, CH-22), 1.51~1.58 (m, 1H, CH2-30a), 1.36~1.41 (m, 1H, CH2-3a), 1.35~1.42 (m, 1H, CH-18), 1.20~1.31 (m, 1H, CH2-13b), 1.17~1.28 (m, 1H, CH-17), 1.17~1.28 (m, 1H, CH-23), 1.16~1.24 (m, 1H, CH2-3b), 1.10~1.12 (m, 1H, CH-15), 1.05 (d, 3H, J=5.7 Hz, CH3-29), 1.03~1.07 (m, 1H, CH2-30b), 0.81~0.89 (m, 3H, CH3-31), 0.80~0.90 (m, 1H, CH2-19b), 0.80~0.90 (m, 1H, CH2-21b); 13C NMR (125 MHz, DMSO-d6) δ: 193.0 (C-28), 175.7 (C-7), 172.2 (C-9), 165.4 (C-27), 150.0 (CH-11), 139.0 (CH-25), 124.0 (CH-26), 121.3 (CH-10), 100.3 (C-8), 72.6 (14-CH), 70.1 (CH-4), 68.6 (CH-5), 59.1 (CH-15), 58.0 (CH-16), 53.5 (CH-18), 47.4 (CH-22), 46.4 (CH-17), 45.6 (CH-12), 43.5 (CH-23), 41.8 (CH2-13), 41.4 (CH-20), 40.2 (CH2-19), 37.2 (CH2-21), 36.4 (CH2-2), 31.0 (CH2-3), 27.9 (CH2-24), 25.8 (CH2-30), 18.4 (CH3-29), 12.6 (CH3-31); IR (KBr) νmax 3676, 3650, 3630, 3621, 3569, 3402, 1655, 1638, 1596, 1561, 1509, 1459, 1033, 845 cm-1; ESIMS m/z: 513.4 [M+H]+;
4-Deoxydihydromaltophilin (3):浅红色无定型粉末. [α]D21+26 (c 0.15, CH3OH), [α]D18+65 (c 0.21, CH3OH-CHCl39: 1); UV (CH3OH) λmax [log ε/(L·mol-1·cm-1)]: 212 (4.04), 320 (3.73) nm; ECD (c 0.05, CH3OH) λmax [Δε/(L·mol-1·cm-1)]: 221 (+9.6), 249 (–12.7), 328 (+4.6) nm; 1H NMR (500 MHz, DMSO-d6) δ:8.69 (s, 1H, NH-6), 7.83 (t, J=5.8 Hz, 1H, NH-1), 6.93 (d, J=15.5 Hz, 1H, CH-10), 6.56 (dd, J=15.5, 10.4 Hz, 1H, CH-11), 5.90 (t, J=11.3 Hz, 1H, CH-25), 5.73 (d, J=11.3 Hz, 1H, CH-26), 3.81 (s, 1H, CH-5), 3.45~3.55 (m, 1H, CH2-24a), 3.21~3.28 (m, 1H, CH-14), 2.32~2.41 (m, 1H, CH-20), 2.32~2.41 (m, 1H, CH2-2a), 2.06~2.10 (m, 1H, CH-12), 1.96~2.01 (m, 1H, CH2-19a), 1.96~2.01 (m, 1H, CH2-21a), 1.96~2.01 (m, 1H, CH2-24a), 1.71~1.78 (m, 1H, CH2-13a), 1.71~1.78 (m, 1H, CH-16), 1.62~1.65 (m, 1H, CH-22), 1.52~1.58 (m, 1H, CH2-4a), 1.51~1.58 (m, 1H, CH2-30a), 1.30~1.36 (m, 1H, CH-18), 1.30~1.26 (m, 1H, CH2-2b), 1.23~1.34 (m, 1H, CH2-13b), 1.23~1.34 (m, 1H, CH2-3a), 1.23~1.34 (m, 1H, CH-17), 1.23~1.34 (m, 1H, CH-23), 1.08~1.10 (m, 1H, CH2-3b), 1.08~1.10 (m, 1H, CH2-4b), 1.08~1.10 (m, 1H, CH-15), 1.05 (d, 3H, J=6.0 Hz, CH3-29), 1.01~1.06 (m, 1H, CH2-30b), 0.85 (t, J=7.3 Hz, 3H, CH3-31), 0.80~0.87 (m, 1H, CH2-19b), 0.80~0.87 (m, 1H, CH2-21b); 13C NMR (125 MHz, DMSO-d6) δ: 195.8 (C-28), 175.2 (C-7), 171.6 (C-9), 165.6 (C-27), 150.0 (CH-11), 139.0 (CH-25), 124.2 (CH-26), 121.5 (CH-10), 100.7 (C-8), 72.7 (CH-14), 61.1 (CH-5), 59.1 (CH-15), 58.1 (CH-16), 53.5 (CH-18), 47.6 (CH-22), 46.4 (CH-17), 45.7 (CH-12), 43.5 (CH-23), 41.9 (CH2-13), 41.4 (CH-20), 40.3 (CH2-19), 38.1 (CH2-2), 37.3 (CH2-21), 28.1 (CH2-24), 25.8 (CH2-30), 25.8 (CH2-4), 20.5 (CH2-3), 18.4 (CH3-29), 12.6 (CH3-31); IR (KBr) νmax: 3753, 3713, 3692, 3589, 3402, 2366, 1701, 1654, 1596, 1509, 1459, 1022, 799 cm-1; ESIMS m/z: 497.4 [M+H]+.
Maltophilin (4):浅红色无定型粉末. [α]D18+15 (c 0.15, CH3OH), [α]D18+52 (c 0.21, CH3OH-CHCl39: 1); UV (CH3OH) λmax [log ε/(L·mol-1·cm-1)]: 206 (4.05), 316 (3.63) nm; ECD (c 0.05, CH3OH) λmax [Δε/(L·mol-1· cm-1)]: 221 (+14.4), 249 (-12.7), 328 (+3.3) nm; 1H NMR (500 MHz, DMSO-d6) δ:8.94 (s, 1H, NH-6), 7.98 (br s), 6.87 (d, J=15.3 Hz, 1H, CH-10), 6.64 (dd, J=15.4, 10.5 Hz, 1H, CH-11), 5.92 (t, J=11.3 Hz, 1H, CH-25), 5.72 (d, J=11.3 Hz, 1H, CH-26), 3.87 (s, 1H, CH-5), 3.79~3.83 (m, 1H, CH-4), 3.59~3.67 (m, 1H, CH2-24a), 3.22~3.29 (m, 1H, CH2-2a), 2.54~2.62 (m, 1H, CH2-13a), 2.54~2.62 (m, 1H, CH2-2a), 2.34~2.39 (m, 1H, CH-12), 2.34~2.39 (m, 1H, CH-15), 2.34~2.39 (m, 1H, CH-20), 2.20~2.24 (m, 1H, CH-16), 2.05~2.12 (m, 1H, CH2-13b), 2.05~2.12 (m, 1H, CH2-21a), 2.05~2.12 (m, 1H, CH2-19a), 2.05~2.12 (m, 1H, CH-22), 1.96~2.03 (m, 1H, CH2-24a), 1.85~1.93 (m, 1H, CH-23), 1.48~1.58 (m, 1H, CH2-30a), 1.32~1.43 (m, 1H, CH2-3a), 1.32~1.41 (m, 1H, CH-18), 1.16~1.25 (m, 1H, CH2-3b), 1.02~1.08 (m, 1H, CH2-21b), 1.02~1.08 (m, 1H, CH-17), 1.02~1.08 (m, 1H, CH2-30b), 0.96 (d, J=5.9 Hz, 3H, CH3-29), 0.81~0.87 (m, 3H, CH3-31), 0.79~0.88 (m, 1H, CH2-19b); 13C NMR (125 MHz, DMSO-d6) δ: 207.3 (C-14), 193.0 (C-28), 175.6 (C-7), 171.8 (C-9), 165.4 (C-27), 147.7 (CH-11), 138.4 (CH-25), 124.4 (CH-26), 121.9 (CH-10), 100.7 (C-8), 70.1 (CH-4), 68.6 (CH-5), 62.9 (CH-15), 53.2 (CH-18), 51.0 (CH-22), 50.4 (CH-16), 47.7 (CH-12), 46.7 (CH-17), 45.6 (CH2-13), 43.2 (CH-23), 40.4 (CH-20), 39.5 (CH2-19), 38.3 (CH2-21), 36.4 (CH2-2), 31.0 (CH2-3), 27.7 (CH2-24), 25.5 (CH2-30), 17.6 (CH3-29), 12.4 (CH3-31); IR (KBr) νmax: 3752, 3736, 3713, 3670, 3630, 3621, 3589, 3569, 3401, 1655, 1638, 1544, 1509, 1459, 1022, 792 cm-1. ESIMS m/z: 511.3 [M+H]+.
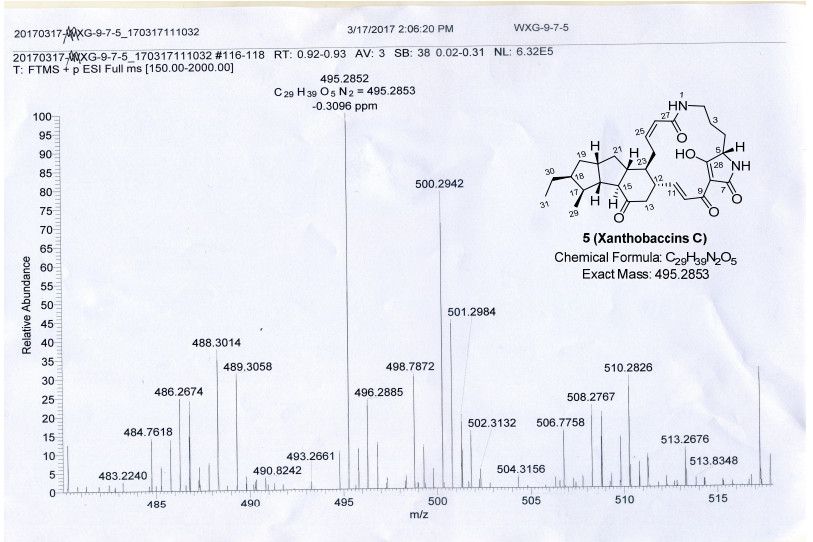
Xanthobaccin C (5):浅红色无定型粉末. [α]D18+13 (c 0.15, CH3OH), [α]D18+40 (c 0.21, CH3OH-CHCl39: 1); UV (CH3OH) λmax [log ε/(L·mol-1·cm-1)]: 206 (3.81), 320 (3.29) nm; ECD (c 0.05, CH3OH) λmax [Δε/(L·mol-1·cm-1)]: 221 (+4.4), 249 (-4.8), 328 (+1.4) nm; 1H NMR (500 MHz, DMSO-d6) δ: 8.73 (s, 1H, NH-6), 7.86 (br s), 6.95 (d, J=15.5 Hz, 1H, CH-10), 6.63 (dd, J=15.5, 10.4 Hz, 1H, CH-11), 5.92 (t, J=11.3 Hz, 1H, CH-25), 5.75 (d, 1H, J=11.3 Hz, CH-26), 3.83 (s, 1H, CH-5), 3.55~3.65 (m, 1H, CH2-24a), 2.56~2.62 (m, 1H, CH2-13a), 2.34~2.39 (m, 2H, CH2-2), 2.34~2.39 (m, 1H, CH-12), 2.34~2.39 (m, 1H, CH-15), 2.34~2.39 (m, 1H, CH-20), 2.18~2.24 (m, 1H, CH-16), 2.01~2.13 (m, 1H, CH2-13b), 2.01~2.13 (m, 1H, CH2-19a), 2.01~2.13 (m, 1H, CH2-21a), 2.01~2.13 (m, 1H, CH-22), 1.84~1.92 (m, 1H, CH2-24b), 1.82~1.92 (m, 1H, CH-23), 1.49~1.57 (m, 1H, CH-4), 1.49~1.57 (m, 1H, CH2-30a), 1.30~1.40 (m, 1H, CH2-3a), 1.30~1.40 (m, 1H, CH-18), 1.01~1.09 (m, 1H, CH2-3b), 1.01~1.09 (m, 1H, CH-4), 1.01~1.09 (m, 1H, CH-17), 1.01~1.09 (m, 1 H, CH2-30b), 1.01~1.00 (m, 1H, CH2-21b), 0.96 (d, J=6.4 Hz, 3H, CH3-29), 0.84 (t, J=7.4 Hz, 3H, CH3-31), 0.80~0.88 (m, 1H, CH2-19b); 13C NMR (125 MHz, DMSO-d6) δ: 207.4 (C-14), 195.8 (C-28), 175.1 (C-7), 171.2 (C-9), 165.5 (C-27), 147.5 (CH-11), 138.3 (CH-25), 124.5 (CH-26), 122.1 (CH-10), 101.0 (C-8), 63.0 (CH-15), 61.1 (CH-5), 53.2 (CH-18), 51.2 (CH-22), 50.4 (CH-16), 47.8 (CH-12), 46.7 (CH-17), 45.6 (CH2-13), 43.2 (CH-23), 40.4 (CH-20), 40.2 (CH2-19), 38.4 (CH2-21), 38.1 (CH2-2), 27.8 (CH2-24), 26.2 (CH2-4), 25.5 (CH2-30), 20.4 (CH2-3), 17.6 (CH3-29), 12.4 (CH3-31); IR (KBr) νmax: 3735, 3651, 3649, 3630, 3621, 3589, 3446, 3402, 2953, 2360, 1647, 1558, 1541, 1508, 1457, 1385, 1207, 1033, 806 cm-1; HRESIMS calcd for C29H39N2O5 [M+H]+ 495.2853, found 495.2852.
30, 31-Dihydrofrontalamide A (6):浅红色无定型粉末, [α]D21+14 (c 0.15, CH3OH), [α]D18+50 (c 0.21, CH3OH-CHCl3, V: V=9: 1); UV (CH3OH) λmax [log ε/(L·mol-1·cm-1)]: 219 (3.9), 322 (3.7) nm; 1H NMR (500 MHz, DMSO-d6) δ: 8.73 (s, 1H, NH-6), 7.87 (t, J=5.6 Hz, 1H, NH-1), 6.96 (d, J=15.6 Hz, 1H, CH-10), 6.59 (dd, J=15.6, 10.1 Hz, 1H, CH-11), 5.96 (t, J=11.3 Hz, 1H, CH-25), 5.77 (dd, J=11.3, 3.6 Hz, 1H, CH-26), 3.83 (br s, 1H, CH-5), 3.60~3.67 (m, 1H, CH2-24a), 2.55~2.63 (m, 1H, CH2-13a), 2.55~2.63 (m, 1H, CH-20), 2.38~2.43 (m, 2H, CH2-2), 2.38~2.43 (m, 1H, CH-12), 2.32 (d, J=13.0 Hz, 1H, CH-15), 2.10~2.14 (m, 1H, CH2-13b), 2.10~2.14 (m, 1H, CH2-21a), 2.01~2.05 (m, 1H, CH2-19a), 2.01~2.04 (m, 1H, CH-22), 2.01~2.04 (m, 1H, CH2-24a), 1.82~1.91 (m, 1H, CH-23), 1.50~1.55 (m, 1H, CH-4), 1.47~1.58 (m, 1H, CH2-30a), 1.47~1.58 (m, 1H, CH-18), 1.29~1.37 (m, 1H, CH2-3a), 1.21~1.25 (m, 1H, CH-17), 0.97~1.04 (m, 1H, CH2-3b), 0.97~1.04 (m, 1H, CH-4), 0.97~1.04 (m, 1H, CH2-30b), 0.96~1.04 (m, 1H, CH2-21b), 0.94 (d, J=6.6 Hz, 3H, CH3-29), 0.84 (t, J=7.1 Hz, 3H, CH3-31), 0.67 (q like, J=12.5 Hz, 1H, CH2-19b); 13C NMR (125 MHz, DMSO-d6) δ: 210.1 (C-14), 195.8 (C-28), 175.1 (C-7), 171.3 (C-9), 165.6 (C-27), 147.1 (CH-11), 138.1 (CH-25), 124.7 (CH-26), 122.3 (CH-10), 101.1 (C-8), 89.7 (C-16), 64.2 (CH-15), 61.1 (CH-5), 51.3 (CH-22), 50.4 (CH-18), 49.3 (CH-17), 48.0 (CH-20), 47.2 (CH-12), 46.0 (CH2-13), 43.0 (CH-23), 38.6 (CH2-19), 38.1 (CH2-2), 36.5 (CH2-21), 27.5 (CH2-24), 26.1 (CH2-4), 25.3 (CH2-30), 20.4 (CH2-3), 12.0 (CH3-31), 11.5 (CH3-29); IR (KBr) νmax: 3667, 3645, 3629, 3618, 3588, 3572, 3403, 1651, 1644, 1600, 1561, 1509, 1459, 1103, 921 cm-1; ESIMS m/z: 533.3 [M+Na]+, 509.2 [M-H]-.
3.2.3 生物活性测试
3.2.3.1 抗肿瘤活性测试
实验样品:准确称量分离纯化好的化合物1~5, 用细胞生物级二甲基亚砜(DMSO)溶解配置成初浓度为4 mmol·L-1(测试L-02细胞时最大初浓度为100 mmol· L-1); 阳性药为阿霉素、浓度用DMSO配置成0.2 mmol·L-1.
细胞系及细胞继代培养:活性测试采用7株人癌细胞系A549、MCF-7、HCT-116、PANC-1、BXPC-3、K562和Jurkat以及人正常肝细胞系L-02.其中A549、MCF-7、Jurkat、BXPC-3、L-02细胞系采用噻唑蓝(MTT)比色法测试; HCT-116、PANC-1和K562细胞系采用磺酰罗丹明B比色法(Sulforhodamine B, SRB)测试; 各种细胞均用含10% FBS的RPMI-1640培养基, 在37 ℃通入5%二氧化碳的培养箱中继代培养.
MTT法:活细胞线粒体中脱氢酶能够代谢还原黄色的溴化3-(4, 5-二甲基噻唑)-2, 5-二苯基四氮唑为蓝紫色的不溶于水的甲瓒, 甲瓒的多少可通过酶标仪测定其吸收度求得.由于甲瓒的量与活细胞数成正比, 所以可根据吸收度求出活细胞的数目, 从而了解药物抑制或杀伤肿瘤细胞的能力.活性测试时, 取对数生长期的测试细胞系, 用新鲜的RPMI-1640培养基配制成密度为每毫升3×104个细胞的细胞悬液, 按每孔100 μL接种于96孔板中, 在37 ℃下培养24 h.吸取10 μL化合物及阳性药加990 μL RPMI-1640稀释, 采用二倍稀释法稀释成5个梯度浓度, 然后分别取100 μL加96孔板中(空白照加入等量RPMI-1640培养基), 继续培养72 h.然后加入20 μL含MTT的IPMI-1640溶液(5 mg/L), 继续培养4 h后, 将培养液慢慢倾出再加入150 μL DMSO溶解甲瓒, 在540 nm处测定其吸收度, 每个梯度浓度3个平行.按照下式计算每个浓度下的细胞增殖抑制率: IR%=(OD空白对照-OD样品)/OD空白对照×100%.并采用bliss法计算出半数抑制浓度IC50 (L-02细胞为CC50).
SRB法:根据细胞生长速率, 将处于对数生长期的肿瘤细胞(培养基:含10%新生胎牛血清FBS的RPMI-1640培养基; 细胞密度3×104细胞/mL)以180 μL/孔接种于96孔培养板, 在37 ℃、5% CO2条件下贴壁生长24 h再加测试样品20 μL /孔, 每个浓度设四复孔.样品初筛终浓度设为10 μmol·L-1, 测试IC50时用二倍稀释法设定5~7个浓度梯度; 阳性药为阿霉素1 μmol·L-1; 空白对照为加入等量的相应浓度的培养基.加药后的肿瘤细胞在37 ℃、5% CO2条件下继续培养72 h, 倾去培养液, 用10%冷三氯醋酸固定细胞, 4 ℃放置1 h后用蒸馏水洗涤5次, 空气中自然干燥.然后按100 μL/孔加入由1%冰醋酸配制的、浓度为4 mg/mL的SRB溶液, 室温中染色15 min, 去上清液, 用1%醋酸洗涤5次, 空气干燥.最后加入150 μL/孔的Tris溶液, 用酶标仪在540 nm波长下测定吸收度OD值.按照IR%=(OD空白对照-OD样品)/OD空白对照×100%计算每个浓度下的细胞增殖抑制率(IR%).并采用bliss法计算出半数抑制浓度IC50 (L-02细胞为CC50).
选择指数(Selection Index, SI)为测试样品对正常细胞株L-02生长抑制CC50值与对肿瘤细胞增殖抑制IC50值的比值, 可在一定程度上间接反映样品的选择性、安全性.
3.2.3.2 抗烟曲霉活性测试
实验样品:准确称量化合物1~6用DMSO配成10 mg/mL初始溶液, 阳性药伊曲康唑配成1 mg/mL溶液, 分别取10 μL加入990 μL无菌水释液100倍, 分别配成浓度为100 μg/mL和10 μg/mL工作液, 待用.
RPMI-1640培养基配制:取6.906 g的3-吗啉丙磺酸(MOPS)溶解在70 mL 70 ℃蒸馏水中, 继续加入4 g的葡萄糖, 待溶解冷却后, 再加入2.08 g固体RPMI1640培养基, 补充蒸馏水到90 mL; 将0.5 g的NaOH溶解于10 mL蒸馏水中, 缓缓加入培养基中, 调节pH至7.0;配制好的培养基经过0.2 mm微孔滤膜过滤除菌, 4 ℃保存备用.
烟曲霉菌液制备:刮取PDA平板培养基上生长良好的烟曲霉(A. fumigates AF29) 成熟孢子于4 mL的生理盐水中, 研钵研匀后倒入试管中, 静置10 min, 取液面下方1/2~2/3处的液体, 通过血球计数板计数, 用无菌RPMI-1640培养基稀释至菌液终浓度为2.0×104 CFU/mL.
96孔板比浊法:阴性对照组每孔加入空白RPMI-1640培养基和无菌蒸馏水各100 μL, 生长对照组每孔加入A. fumigates AF29菌液和无菌蒸馏水各100 μL; 阳性对照组每孔加入A. fumigates AF29菌液和阳性药工作液各100 μL.每空加入菌液和测试样品工作液各100 μL, 使每孔化合物和阳性药的测试终浓度为加样前工作液浓度的1/2.每空各做3个平行实验.加完样品的培养板水平摇动3 min左右, 然后置于湿盒中, 于28 ℃培养箱中培养3~5 d后进行观察; 肉眼观察, 以生长对照作为参照标准.若在此浓度下有活性, 则在加药前用无菌蒸馏水将工作液采用二倍稀释法依次稀释后进行测试, 直至测出化合物的MIC值, 以烟曲霉菌生长变化明显的折点作为MIC终点.
-
-
[1]
赵成英, 朱统汉, 朱伟明, 有机化学, 2013, 33, 1195. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract342155.shtmlZhao, C.; Zhu, T.; Zhu, W. Chin. J. Org. Chem. 2013, 33, 1195(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract342155.shtml
-
[2]
Blodgett, J. A.; Oh, D. C.; Cao, S.; Currie, C. R.; Kolter, R.; Clardy, J. Proc. Natl. Acad. Sci. U. S. A. 2010, 107, 11692. doi: 10.1073/pnas.1001513107
-
[3]
Zhang, G.; Zhang, W.; Saha, S.; Zhang, C. Curr. Top Med. Chem. 2016, 16, 1727. doi: 10.2174/1568026616666151012112818
-
[4]
Jomon, K.; Kuroda, Y.; Ajisaka, M.; Sakai, H. J. Antibiot. 1972, 25, 271. doi: 10.7164/antibiotics.25.271
-
[5]
Gunasekera, S. P.; Gunasekera, M.; McCarthy, P. J. Org. Chem. 1991, 56, 4830. doi: 10.1021/jo00016a006
-
[6]
Kanaxawa, S.; Fusetani, N.; Matsunaga, S. Tetrahedron Lett. 1993, 34, 1065. doi: 10.1016/S0040-4039(00)77493-4
-
[7]
Jakobi, M.; Winkelmann, G.; Kaiser, D.; Kempter, C.; Jung, G.; Berg, G.; Bahl, H. J. Antibiot. 1996, 49, 1101. doi: 10.7164/antibiotics.49.1101
-
[8]
Graupner, P. R.; Hornburgh, S. T.; Mathiesonc, J. T.; Chapin, E. L.; Kemmitt, G. M.; Brown, J. M.; Snipes, C. E. J. Antibiot. 1997, 50, 1014. doi: 10.7164/antibiotics.50.1014
-
[9]
Yu, F.; Zaleta-Rivera, K.; Zhu, X.; Huffman, J.; Millet, J. C.; Harris, S. D.; Yuen, G.; Li, X. C.; Du, L. Antimicrob. Agents Chemother. 2007, 51, 64. doi: 10.1128/AAC.00931-06
-
[10]
Nakayama, T.; Homma, Y.; Hashidoko, Y.; Mizutani, J.; Tahara, S. Appl. Environ. Microbiol. 1999, 65, 4334. doi: 10.1007/s10327-005-0243-y
-
[11]
Li, Y.; Huffman, J.; Li, Y.; Du, L.; Shen, Y. Med. Chem. Commun. 2012, 3, 982. doi: 10.1039/c2md20026k
-
[12]
Xu, L.; Wu, P.; Wright, S. J.; Du, L.; Wei, X. Y. J. Nat. Prod. 2015, 78, 1841. doi: 10.1021/acs.jnatprod.5b00099
-
[13]
Saha, S.; Zhang, W.; Zhang, G.; Zhu, Y. G.; Chen, Y. C.; Liu, W.;Yuan, C. S.; Zhang, Q. B.; Zhang, H. B.; Zhang, L. P.; Zhnag, W. M.; Zhang, C. S. Chem. Sci. 2017, 8, 1607. doi: 10.1039/C6SC03875A
-
[14]
Li, S.; Du, L.; Yuen, G.; Harris, S. D. Mol. Biol. Cell 2006, 17, 1218. http://www.fgsc.net/Aspergillus/gene_list/refs06.html
-
[15]
Li, S.; Calvo, A. M.; Yuen, G. Y.; Du, L.; Harris, S. D. J. Eukaryot. Microbiol. 2009, 56, 182. doi: 10.1111/jeu.2009.56.issue-2
-
[16]
Li, S.; Jochum, C. C.; Yu, F.; Zaleta-Rivera, K.; Du, L.; Harris, S. D.; Yuen, G. Y. Phytopathology 2008, 98, 695. doi: 10.1094/PHYTO-98-6-0695
-
[17]
Qian, G.; Hu, B.; Jiang, Y.; Liu, F. Agric. Sci. China 2009, 8, 68. doi: 10.1016/S1671-2927(09)60010-9
-
[18]
Lou, L.; Chen, H.; Cerny, R. L.; Li, Y.; Shen, Y.; Du, L. Biochemistry 2012, 51, 4. doi: 10.1021/bi2015025
-
[19]
Lou, L.; Qian, G.; Xie, Y.; Hang, J.; Chen, H.; Zaleta-Rivera, K.; Li, Y.; Shen, Y.; Dussault, P. H.; Liu, F.; Du, L. J. Am. Chem. Soc. 2011, 133, 643. doi: 10.1021/ja105732c
-
[20]
Fu, P.; Wang, S.; Hong, K.; Li, X.; Liu, P.; Wang, Y.; Zhu, W. J. Nat. Prod. 2011, 74, 1751. doi: 10.1021/np200258h
-
[21]
贾海健, 王聪, 王乂, 刘培培, 朱伟明, 中国海洋药物, 2014, 33, 9. http://www.cqvip.com/QK/91183X/201403/49775312.htmlJia, H.-J.; Wang, C.; Wang, Y.; Liu, P.-P.; Zhu, W.-M. Chin. J. Mar. Drug. 2014, 33, 9(in Chinese). http://www.cqvip.com/QK/91183X/201403/49775312.html
-
[22]
Lacret, R.; Oves-Costales, D.; Gómez, C.; Díaz, C.; de la Cruz M; Pérez-Victoria, I.; Vicente, F.; Genilloud, O.; Reyes, F. Mar. Drugs 2014, 13, 128. doi: 10.3390/md13010128
-
[1]
-
表 1 化合物1的1H NMR (500 MHz)和13C NMR (125 MHz)数据(DMSO-d6)
Table 1. 1H NMR (500 MHz) and 13C NMR (125 MHz) data for compound 1 (DMSO-d6)
Position δC δH(J in Hz) Position δC δH(J in Hz) 1-NH 7.99, t (5.8) 17 49.3, CH 1.17~1.24, m 2 36.4, CH2 3.24~3.27, m; 2.56~2.62, m 18 50.4, CH 1.48~1.55, m 3 31.0, CH2 1.38~1.43, m; 1.17~1.24, m 19 38.1, CH2 2.01~2.05, m; 0.68, q like (12.5) 4 70.1, CH 3.80~3.84, m 20 47.9, CH 2.56~2.62, m 5 68.6, CH 3.87, s 21 36.5, CH2 2.10~2.14, m; 0.96~1.03, m 6-NH 8.95, s 22 51.3, CH 2.01~2.05, m 7 175.6, C 23 43.0, CH 1.84~1.91, m 8 100.7, C 24 27.4, CH2 3.61~3.69, m; 2.01~2.05, m 9 171.9, C 25 138.2, CH 5.96, t (11.3) 10 122.1, CH 6.88, d (15.6) 26 124.5, CH 5.75, dd (11.3, 3.5) 11 147.4, CH 6.60, dd (15.6, 10.4) 27 165.5, C 12 47.1, CH 2.40~2.48, m 28 193.0, C 13 46.0, CH2 2.56~2.62, m; 2.10~2.14, m 29 11.5, CH3 0.94, d (6.4) 14 210.1, C 30 25.3, CH2 1.48~1.55, m; 0.96~1.03, m 15 64.2, CH 2.32, d (13.0) 31 12.0, CH3 0.84, t (7.3) 16 89.7, C 表 2 化合物1~5的细胞毒活性[IC50或CC50/(μmol·L-1)]和选择指数(SI=CC50/IC50)
Table 2. Cytotoxicities [IC50 or CC50/(μmol·L-1)] and selection indexes (SI=CC50/IC50) of compounds 1~5
Cell line 1 2 3 4 5 Adriamycin A549 9.5/24.8 0.3/9.3 0.9/1.6 3.6/4.5 >10/- 1.3/0.31 K562 >10/- 4.9/0.6 5.7/0.2 >10/- >10/- 0.3/1.33 MCF-7 9.7/24.3 0.1/28.0 0.4/3.5 3.3/4.9 3.4/4.3 1.0/0.4 HCT-116 5.7/41.4 2.9/1.0 2.9/0.5 4.4/3.7 4.6/3.2 0.2/2.0 Jurkat 7.5/31.5 1.7/1.6 1.4/1.0 1.9/8.5 6.7/2.2 0.4/1.0 PANC-1 7.9/29.9 2.1/1.3 2.3/0.6 5.4/3.0 7.0/2.1 1.0/0.4 BXPC-3 4.5/52.4 4.3/0.7 2.9/0.5 4.1/3.9 4.0/3.6 0.7/0.6 L-02a 235.9 2.8 1.4 16.1 14.5 0.4 表 3 化合物1~6的抗烟曲霉(A. fumigatus AF 293) 活性[MIC/(μg·mL-1)]
Table 3. Antifungal activity of compounds 1~6 against Aspergillus fumigatus AF293 [MIC/(μg·mL-1)]
Compd. 50 25 12.5 6.25 3.125 1.5625 0.78125 1 - - - - - 2 + + + + + + - 3 + + - - - 4 + + + + + - - 5 + + - - - 6 - - - - - a+Tested with obvious inhibition activity; b-tested without observed inhibition activity. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 21
- 文章访问数: 2335
- HTML全文浏览量: 512


 下载:
下载:


 下载:
下载:

