 图1
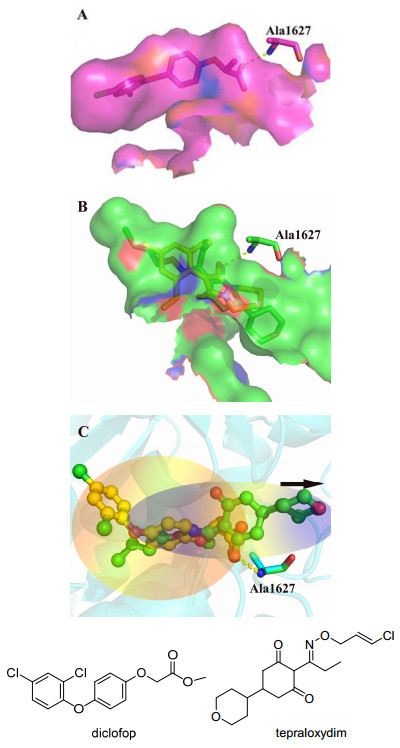
(A) 晶体结构1UYS中APP-活性腔表面积显示图、(B)晶体结构3K8X中CHD-活性腔表面积显示图、(C) APP-活性腔和CHD-活性腔相对位置叠合图
Figure1.
(A) APP-binding site (based on 1UYS) was shown in solid surface, (B) CHD-binding site (based on 3K8X) was shown in solid suface, and (C) overlay of APP-binding site and CHD-binding site
图1
(A) 晶体结构1UYS中APP-活性腔表面积显示图、(B)晶体结构3K8X中CHD-活性腔表面积显示图、(C) APP-活性腔和CHD-活性腔相对位置叠合图
Figure1.
(A) APP-binding site (based on 1UYS) was shown in solid surface, (B) CHD-binding site (based on 3K8X) was shown in solid suface, and (C) overlay of APP-binding site and CHD-binding site

Citation: Li Kejian, Wu Shuangzhi, Wang Nannan, Zhu Xiaolei, Yang Guangfu. Design, Synthesis and Bioactivity of New Cyclohexanedione Inhibitors[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2978-2984. doi: 10.6023/cjoc201706029

新型环己二酮类抑制剂的设计、合成及其生物活性研究
English
Design, Synthesis and Bioactivity of New Cyclohexanedione Inhibitors
-
Key words:
- ACCase
- / molecular docking
- / organic synthesis
- / herbicidal activity
-
乙酰辅酶A羧化酶(Acetyl-CoA Carboxylase, ACCase, EC 6.4.1.2)是植物代谢过程中催化植物脂肪酸合成途径中的一个关键酶, 已经发展成为当前最为重要的除草剂靶标之一[1, 2].作用于该靶标的商品化除草剂主要包括芳氧苯氧丙酸酯类(Aryloxyphenoxypropanoates, APP)、环己二酮类(Cyclohexanedione oximes, CHD)和苯基吡唑啉类(Phenylpyrazoline, DEN)三类[3, 4].其中APP、CHD和DEN主要用于防除一年或多年生禾本科杂草, 对很多阔叶植物安全, 尤其对后茬作物安全.然而由于大面积连续使用, 杂草抗性发展日趋严重[5, 6].据HRAC (Herbicide resistance action committee)统计, 截止2015年, 靶向ACCase的抗性杂草物种数目已然跃居第三位[7, 8].纵观靶向ACCase除草剂的开发历程, APP和CHD多为20世纪90年代或更早时间开发的产品, Pinoxaden为2005年开发成功的产品, 到目前为止, 十多年过去了, 再没有一个新产品问世!因此, 开发新型靶向ACCase的除草剂先导化合物已迫在眉睫.
Tong等分别于2003年(1UYS: halxoyfop; 1UYR: diclofop)、2009年(3K8X: tepraloxydim)和2010年(3PGQ: pinoxaden)报道了APP、CHD和DEN三类抑制剂与ACCase的晶体复合物结构, 明确了三类抑制剂的作用机制及其差异性[9, 11].根据抑制剂与ACCase的结合模式, 我们将ACCase的活性腔分为三类: APP-活性腔(图 1A)、CHD-活性腔(包含pinoxaden, 图 1B), 值得关注的是, APP-活性腔和CHD-活性腔存在差异(图 1C), 相同点为APP类抑制剂中羧基氧原子与CHD类抑制剂中环己二酮中的氧原子空间位置完全重叠, 均与Ala1627形成Hbond(图 1C), 不同点为二者分别占据了靶酶的不同部位.因此根据药物分子设计理念, 增强药物分子与受体的相互作用面积是一种有效的增强化合物活性的方法之一[12].基于此, 我们基于CHD类抑制剂的基本骨架, 引入APP类抑制剂中芳氧苯氧部分, 设计并合成了一类新型ACCase抑制剂先导结构.所有最终化合物结构经1H NMR、13C NMR和HRMS表征.
 图1
(A) 晶体结构1UYS中APP-活性腔表面积显示图、(B)晶体结构3K8X中CHD-活性腔表面积显示图、(C) APP-活性腔和CHD-活性腔相对位置叠合图
Figure1.
(A) APP-binding site (based on 1UYS) was shown in solid surface, (B) CHD-binding site (based on 3K8X) was shown in solid suface, and (C) overlay of APP-binding site and CHD-binding site
图1
(A) 晶体结构1UYS中APP-活性腔表面积显示图、(B)晶体结构3K8X中CHD-活性腔表面积显示图、(C) APP-活性腔和CHD-活性腔相对位置叠合图
Figure1.
(A) APP-binding site (based on 1UYS) was shown in solid surface, (B) CHD-binding site (based on 3K8X) was shown in solid suface, and (C) overlay of APP-binding site and CHD-binding site
1 结果与讨论
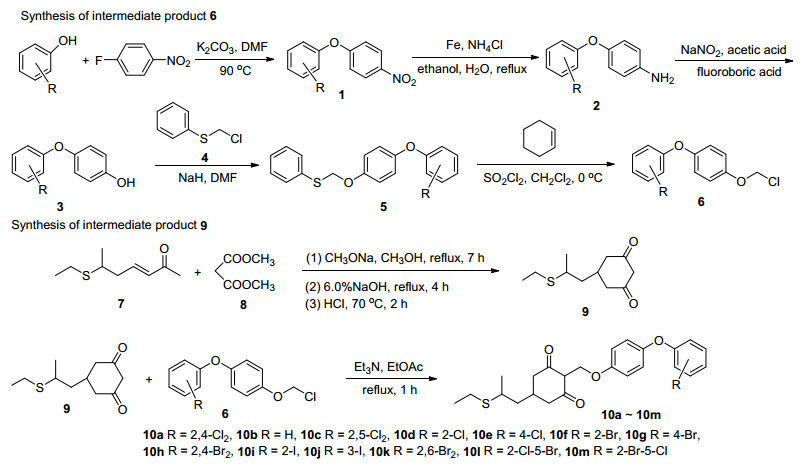
1.1 目标化合物10a~10m的合成
1.1.1 中间体3和6的合成
在合成该系列化合物的过程中, 二苯醚的硝基化合物1的获得是该合成的关键步骤.通过各种取代的酚和带有强吸电子基团的对氟硝基苯发生苯环上的SNAr反应, 经过简单的后处理就能得到中间体二苯醚的硝基化合物1, 然后经过铁粉还原得到氨基二苯醚2, 再经过重氮化、氟硼酸酸化形成稳定的氟硼酸重氮盐, 最后经过碱化、酸化等反应, 最后纯化得到取代的4-苯氧基苯酚3[13, 14].
中间体6的合成分为两步进行, 首先由中间体3在NaH的作用下生成二苯醚氧负离子, 再加入反应物4后得到中间体5, 然后参考文献报道的合成方法, 加入环己烯和磺酰氯[15], 无需进一步纯化即可得到中间体6 (Scheme 1).
1.1.2 中间体9的合成
目前文献中关于中间体9的合成方法主要是通过6-乙硫基庚烷-3-烯-2-酮与丙二酸二甲酯经Michael加成和Claisen缩合反应合成中间产物4-甲氧羰基-5-[2-(乙硫基)丙基]-1, 3-环己二酮, 然后再皂化、脱羧即得目标化合物, 但文献报道使用的甲醇钠浓度高, 容易引起原料的自身缩合, 同时对合成得到的4-甲氧羰基化合物需进行分离、水解和皂化过程, 这样使得最终的产品收率低, 杂质较多, 后处理麻烦[16].本文通过将无水甲醇加入到甲醇钠中以获得较适宜的浓度, 即0.1 mol化合物7需加入甲醇20 mL, 能够较好的避免原来的自身缩合, 从而提高了产品收率.于此同时缩合反应中使用的氢氧化钠的量也需要控制, 主要是因为所加入的氢氧化钠存在双重作用:参与酯水解和亚甲基烯醇化.通过实验条件的摸索, 我们发现氢氧化钠与乙酰乙酸甲酯的物质的量比为2~2.5:1时, 收率比较好, 实验结果稳定.最后总收率(以乙酰乙酸甲酯为基准)可达到80%以上(Scheme 1)
1.1.3 化合物10a~10m的合成
以中间体9和6为反应起始原料, 此时需要注意的是中间体9先与三乙胺反应, 活化环己二酮, 再加入中间体6, 发生C-烷基化反应, 最后纯化得到目标化合物(Scheme 1).
1.2 作用机制研究
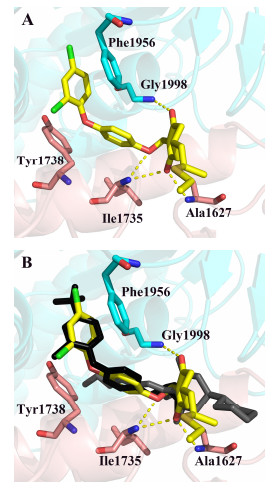
为了更进一步研究目标化合物与靶酶的作用机制, 采用分子对接方法研究化合物与靶酶之间的作用模式.代表性化合物10a与ACCase的结合模式如图 2A所示, 该化合物主要与Phe1956、Tyr1738形成π-π“三明治”型相互作用, 与Ile1735、Ala1627、Gly1998形成氢键.化合物10a(黄色stick)与haloxyfop (1UYS, 黑色stick)、tepraloxydim (3K8X, 灰色stick)在活性腔中相对位置叠合图如图 2B所示, 由此可见化合物10a同时占据了APP活性腔和CHD活性腔, 属于新型ACCase抑制剂结构类型.
1.3 化合物10a~10m的除草活性测定
室内苗后除草活性如表 1所示, 其中对照药剂烯草酮对禾本科杂草表现出高除草活性, 但对阔叶杂草完全无效.但是, 本文所合成的部分化合物对阔叶杂草(苘麻、反枝苋、鱧肠)和禾本科杂草(马唐、稗草和狗尾草)均表现出了一定的抑制效果.如化合物10a、10b、10d、10e、10h对反枝苋的抑制率均大于等于50%, 化合物10a、10b、10c对鱧肠的抑制率均为50%, 而对照药剂烯草酮对反枝苋、鱧肠的抑制率为0;同时, 化合物10b表现出了较宽的除草谱, 不仅对禾本科杂草表现出50%的除草活性, 而且对阔叶杂草反枝苋和鱧肠也表现出50%的除草活性.以上结果表明, 本文的分子设计策略是可行的, 有望设计出能同时防治禾本科杂草和阔叶杂草的新型ACCase抑制剂.
 表 1
化合物10a~10m苗后室内除草活性(抑制率/%)
Table 1.
Post-emergence herbicidal activity (inhibition rate/%) of compounds 10a~10m
表 1
化合物10a~10m苗后室内除草活性(抑制率/%)
Table 1.
Post-emergence herbicidal activity (inhibition rate/%) of compounds 10a~10m
化合物 剂量/
(g a.i.·ha-1)苘麻 反枝苋 鱧肠 马唐 稗草 狗尾草 10a 150 0 70 50 0 50 0 10b 150 30 50 50 50 50 50 10c 150 0 40 50 0 30 0 10d 150 0 50 30 0 0 0 10e 150 0 60 40 30 40 0 10f 150 30 40 30 50 0 50 10g 150 30 0 30 0 30 0 10h 150 0 50 0 0 0 0 10i 150 30 20 30 0 0 20 10j 150 0 30 40 0 30 0 10k 150 0 20 30 0 0 0 10l 150 30 0 30 0 0 0 10m 150 20 0 30 0 0 20 烯草酮 150 0 0 0 100 100 100 2 结论
本文基于经典APP和CHD抑制剂结合模式的差异性, 基于CHD类抑制剂的基本骨架, 引入芳氧苯氧片段, 设计了一类新型ACCase抑制剂结构, 以取代的苯酚和对氟硝基苯为起始原料, 以中等偏上的收率合成了目标化合物10a~10m.采用分子对接方法确认了该类抑制剂与靶酶的作用机制, 代表性化合物10a与Phe1956、Tyr1738形成π-π“三明治”型相互作用, 与Ile1735、Ala1627、Gly1998形成氢键, 同时占据了APP和CHD两个活性腔.进一步的室内苗后除草活性筛选表明, 化合物10b表现出较广的除草谱, 不仅对禾本科杂草具有除草活性, 而且对阔叶杂草也表现出除草活性.因此, 该类抑制剂具有进一步研究的潜力, 并为新型ACCase抑制剂的设计提供了新方向和新思路.
3 实验部分
3.1 仪器与试剂
ZF-20D型三用紫外灯, He10dolph MP3001型恒温磁力搅拌器, Buch10数字显示显微熔点测定仪, BS223S型分析天平, SHZ-D(101010)循环水式真空泵, Buch10 R210型旋转蒸发器, 600 MHz超导核磁共振仪(Var10an 600 M).所用试剂均为分析纯.
3.2 实验方法
3.2.1 中间体3的合成
在500 mL两口圆底烧瓶中, 加入5 g 4-(2-氯苯氧基)苯胺[17~19] (22.8 mmol)溶于适量冰醋酸中, 滴加适量的48%氟硼酸, 室温反应1 h, 将反应液移入0 ℃的反应器中, 将4.71 g亚硝酸钠(68.4 mmol)溶于适量水中, 配成溶液, 缓慢滴加到反应瓶中, 滴加完毕, 继续反应1 h, 抽滤得固体.
在另一只500 mL两口圆底烧瓶中, 加入一定量的醋酸酐, 将上步得到的固体物质加入反应瓶中.缓慢升温至110~120 ℃, 薄层色谱(TLC)板监测反应进行状态[展开剂为V(石油醚):V(乙酸乙酯)=4:1].反应完毕后, 用乙酸乙酯、大量水萃取, 分离有机相, 用大量水洗有机相3~5次, 用无水硫酸钠干燥, 加压旋干溶剂, 经硅胶柱分离产物得中间体3, 产率65%. m.p. 54~55 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 9.40 (s, 1H), 7.54 (d, J=6.0 Hz, 1H), 7.31~7.24 (m, 1H), 7.12~7.06 (m, 1H), 6.89~6.84 (m, 3H), 6.80~6.77 (m, 2H). HRMS calcd for C12H10ClO2 [M+H]+ 221.0369; found 221.0372.
3.2.2 中间体9的合成
在100 mL二口烧瓶中加入25 mL浓度为30%的工业甲醇钠, 20 mL无水甲醇, 2.53 g丙二酸二甲酯(19.2 mmol), 搅拌滴加3 g 6-乙硫基庚烷-3-烯-2-酮[20, 21] (17.4 mmol), 滴加完毕后回流反应7 h, 浓缩回收无水甲醇, 然后加入50 mL质量百分浓度为6.0%的NaOH溶液, 继续回流4 h后, 降至室温, 用乙酸乙酯萃取(25 mL×2)除去杂质, 水相在70 ℃下用12%的盐酸调节pH=3, 搅拌反应6 h, TLC板监测反应[展开剂为V(石油醚):V(丙酮)=2:1].反应液用乙酸乙酯萃取(30 mL×3), 无水硫酸镁干燥, 减压脱除溶剂后得到桔红色粘稠状液体, 经硅胶柱分离得纯净的中间体9, 产率为80%. 1H NMR (400 MHz, CDCl3) δ: 5.48 (d, J=7.2 Hz, 1H), 3.39 (d, J=8.8 Hz, 1H), 2.84~2.68 (m, 2H), 2.53 (dd, J=7.2, 2.4 Hz, 2H), 2.39 (ddd, J=14.0, 9.6, 5.2 Hz, 2H), 2.12 (dd, J=16.4, 10.4 Hz, 1H), 1.67~1.40 (m, 2H), 1.29 (d, J=6.4 Hz, 3H), 1.27~1.22 (m, 3H). HRMS calcd for C11H19O2S [M+H]+ 215.1106; found 215.1108.
3.2.3 目标化合物10a~10m的合成
在100 mL单口烧瓶中加入中间体9 (2.65 mmol), 一定体积的干燥乙酸乙酯溶剂, 室温搅拌下滴加溶于乙酸乙酯中的三乙胺(7.95 mmol), 滴加完毕继续搅拌10 min.在另一个100 mL加入中间体6 (2.65 mmol)[22]和适量的乙酸乙酯溶剂, 逐滴加入第一个反应瓶中的反应液, 滴加完毕加热回流1 h, TLC板监测.反应完毕, 旋干溶剂, 用硅胶柱分离提纯的产品.
2-([4-(2, 4-二氯苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10a):产率68%, 黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.43 (d, J=2.4 Hz, 1H), 7.14 (dd, J=12.0, 8.0 Hz, 1H), 6.98 (d, J=8.0 Hz, 2H), 6.92~6.88 (m, 2H), 6.82 (d, J=12.0 Hz, 1H), 5.69 (s, 1H), 5.59~5.52 (m, 2H), 2.85~2.75 (m, 1H), 2.51 (m, 3H), 2.44 (s, 1H), 2.18~2.16 (m, 1H), 2.09~2.00 (m, 1H), 1.67~1.48 (m, 2H), 1.34~1.16 (m, 7H); 13C NMR (400 MHz, CDCl3) δ: 198.62, 173.81, 152.50, 151.46, 130.22, 128.55, 127.78, 125.75, 120.20, 119.47, 117.40, 105.08, 90.05, 43.06, 42.74, 36.59, 34.97, 31.11, 24.19, 23.86, 22.23, 14.92. HRMS calcd for C24H27Cl2O4S [M+H]+ 481.1002; found 481.0997.
5-[2-(乙硫基)丙基]-2-[(4-苯氧基苯氧基)甲基]环己-1, 3-二酮(10b):产率52%, 黄色油状物体. 1H NMR (400 MHz, CDCl3) δ: 7.22 (d, J=8.0 Hz, 2H), 6.99 (t, J=6.8 Hz, 1H), 6.88 (d, J=13.2 Hz, 6H), 5.62 (s, 1H), 5.50 (s, 2H), 2.74 (s, 1H), 2.51~2.41 (m, 3H), 2.38 (s, 1H), 2.20~2.10 (m, 1H), 1.99 (t, J=13.6 Hz, 1H), 1.65~1.40 (m, 3H), 1.28~1.14 (m, 6H); 13C NMR (400 MHz, CDCl3) δ: 198.65, 186.24, 173.82, 152.01, 129.50, 122.74, 120.31, 117.91, 117.27, 105.07, 90.15, 42.80, 36.62, 36.38, 35.02, 34.67, 31.15, 24.25, 22.25, 14.96. HRMS calcd for C24H29O4S [M+H]+ 413.1781; found 413.1780.
2-[4-(2, 5-二氯苯氧基)苯氧基]甲基-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10c):产率60%, 黄色油状物. 1H NMR (600 MHz, CDCl3) δ: 7.38 (d, J=12.0 Hz, 1H), 7.04 (d, J=12.0 Hz, 3H), 6.98 (d, J=12.0 Hz, 2H), 6.85 (s, 1H), 5.72 (s, 1H), 5.61 (s, 2H), 2.82 (s, 1H), 2.60~2.50 (m, 4H), 2.24 (d, J=18.0 Hz, 1H), 2.08 (t, J=12.0 Hz, 1H), 1.62 (d, J=6.0 Hz, 1H), 1.55 (d, J=12.0 Hz, 1H), 1.28 (dd, J=30.0, 12.0 Hz, 7H); 13C NMR (400 MHz, CDCl3) δ: 198.79, 173.84, 153.68, 152.86, 150.71, 132.80, 131.02, 123.73, 122.83, 120.10, 118.75, 117.35, 104.96, 89.80, 42.46, 36.26, 34.65, 34.30, 30.78, 23.86, 21.85, 14.55. HRMS calcd for C24H27Cl2O4S [M+H]+ 481.1002; found 481.1000.
2-([4-(2-氯苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10d):产率47%, 黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.42 (d, J=7.6 Hz, 1H), 7.20~7.13 (m, 1H), 7.03 (dd, J=15.2, 8.0 Hz, 1H), 6.97 (d, J=8.4 Hz, 2H), 6.93~6.84 (m, 3H), 5.68 (s, 1H), 5.56 (s, 2H), 2.80 (s, 1H), 2.60~2.50 (m, 3H), 2.44 (s, 1H), 2.20 (d, J=20.0 Hz, 1H), 2.11~2.00 (m, 1H), 1.67~1.54 (m, 2H), 1.25 (dd, J=16.0, 9.2 Hz, 7H); 13C NMR (400 MHz, CDCl3) δ: 199.26, 174.38, 152.34, 152.00, 130.62, 127.81, 125.10, 124.28, 119.79, 119.36, 117.39, 116.33, 104.98, 90.13, 42.54, 36.42, 34.79, 34.42, 30.93, 23.96, 22.00, 14.72. HRMS calcd for C24H28ClO4S [M+ H]+ 447.1391; found 447.1388.
2-([4-(4-氯苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10e):产率55%, 黄色油状物. 1H NMR (600 MHz, DMSO) δ: 7.40 (s, 2H), 7.08 (d, J=25.8 Hz, 4H), 6.98 (s, 2H), 5.75 (s, 2H), 5.54 (s, 1H), 2.85 (s, 1H), 2.43 (s, 1H), 2.25 (s, 4H), 2.09 (s, 2H), 1.50 (s, 2H), 1.18 (d, J=29.4 Hz, 6H); 13C NMR (400 MHz, CDCl3) δ: 199.16, 174.23, 156.39, 152.58, 151.80, 129.54, 127.74, 120.44, 119.15, 117.46, 105.06, 90.08, 42.58, 36.21, 34.83, 34.45, 30.84, 23.67, 22.03, 14.70 HRMS calcd for C24H28ClO4S [M+H]+ 447.1391; found 447.1389.
2-([4-(2-溴苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10f):产率53%, 黄色油状物. 1H NMR (600 MHz, CDCl3) δ: 7.62 (dd, J=8.4, 1.3 Hz, 1H), 7.24 (d, J=7.8 Hz, 1H), 7.00 (d, J=8.4 Hz, 3H), 6.94 (d, J=9.0 Hz, 2H), 6.90 (d, J=8.4 Hz, 1H), 5.71 (s, 1H), 5.59 (d, J=4.2 Hz, 2H), 2.83~2.80 (m, 1H), 2.54 (d, J=7.2 Hz, 2H), 2.53~2.50 (m, 1H), 2.46 (s, 1H), 2.24~2.19 (m, 1H), 2.08~2.04 (m, 1H), 1.62 (dt, J=14.4, 7.5 Hz, 1H), 1.53 (dt, J=17.4, 7.2 Hz, 1H), 1.29 (t, J=6.0 Hz, 4H), 1.26~1.23 (m, 3H); 13C NMR (400 MHz, CDCl3) δ: 198.21, 154.89, 152.45, 149.47, 133.57, 128.43, 123.90, 120.37, 119.73, 118.56, 117.79, 116.38, 114.38, 113.49, 42.52, 38.38, 36.37, 30.20, 23.86, 21.90, 16.25, 14.75. HRMS calcd for C24H28BrO4S [M+H]+ 491.0886; found 491.0882.
2-([4-(4-溴苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10g):产率51%, 黄色油状物. 1H NMR (600 MHz, CDCl3) δ: 7.40 (t, J=7.2 Hz, 2H), 7.01 (d, J=9.0 Hz, 2H), 6.96 (dd, J=10.2, 4.2 Hz, 2H), 6.87~6.81 (m, 2H), 5.70 (s, 1H), 5.61~5.57 (m, 2H), 2.83~2.79 (m, 1H), 2.54 (q, J=7.2 Hz, 3H), 2.47 (dd, J=16.4, 3.6 Hz, 1H), 2.21 (dt, J=14.4, 6.4 Hz, 1H), 2.10~2.04 (m, 1H), 1.64~1.59 (m, 1H), 1.55~1.51 (m, 1H), 1.32~1.26 (m, 4H), 1.24 (td, J=7.2, 2.4 Hz, 3H); 13C NMR (400 MHz, CDCl3) δ: 199.10, 174.18, 157.02, 152.68, 151.73, 132.54, 120.55, 119.60, 117.51, 116.43, 115.21, 105.13, 90.14, 42.95, 42.65, 36.29, 34.51, 30.90, 24.06, 22.08, 14.74. HRMS calcd for C24H28BrO4S [M+H]+ 491.0886; found 491.0881.
2-([4-(2, 4-二溴苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10h):产率54%, 黄色油状物. 1H NMR (400 MHz, DMSO-d6) δ: 8.28 (dt, J=9.2, 1.2 Hz, 2H), 7.74 (t, J=8.0 Hz, 1H), 7.58 (d, J=9.2 Hz, 2H), 7.32~7.27 (m, 2H), 6.23 (dd, J=5.6, 3.6 Hz, 2H), 6.08 (s, 1H), 3.40 (dd, J=18.0, 10.2 Hz, 3H), 3.10~3.03 (m, 3H), 2.87 (d, J=18.4 Hz, 2H), 2.62 (d, J=1.2 Hz, 2H), 2.11 (d, J=7.2 Hz, 1H), 1.79 (d, J=6.4 Hz, 2H), 1.72 (d, J=7.2 Hz, 2H), 0.55~0.52 (m, 1H); 13C NMR (400 MHz, CDCl3) δ: 198.93, 174.09, 152.13, 151.69, 149.19, 132.99, 127.43, 118.79, 117.36, 115.97, 105.07, 90.34, 42.96, 42.67, 36.30, 34.87, 34.54, 30.89, 24.05, 23.76, 21.71, 14.74. HRMS calcd for C24H27Br2O4S [M+H]+ 568.9991; found 568.9985.
5-[2-(乙硫基)丙基]-2-([4-(2-碘苯氧基)苯氧基]甲基)环己烷-1, 3-二酮(10i):产率61%, 黄色油状物.1H NMR (600 MHz, CDCl3) δ: 7.80 (d, J=7.6 Hz, 1H), 7.23 (d, J=6.8 Hz, 1H), 6.93 (dd, J=26.4, 8.4 Hz, 4H), 6.80 (dd, J=14.4, 7.8 Hz, 2H), 5.66 (s, 1H), 5.54 (s, 2H), 2.78 (s, 1H), 2.48 (dd, J=23.6, 15.2 Hz, 5H), 2.18 (dd, J=15.2, 10.0 Hz, 1H), 2.03 (t, J=12.8 Hz, 1H), 1.66~1.48 (m, 2H), 1.23 (dd, J=16.4, 9.2 Hz, 6H); 13C NMR (400 MHz, CDCl3) δ: 198.90, 174.07, 156.75, 152.45, 151.92, 139.70, 129.52, 125.00, 119.84, 118.43, 117.44, 105.05, 90.09, 88.22, 42.92, 42.61, 36.43, 34.79, 30.83, 23.98, 22.03, 14.77. HRMS calcd for C24H28IO4S [M+H]+ 539.0748; found 539.0746.
5-[2-(乙硫基)丙基]-2-([4-(3-碘苯氧基)苯氧基]甲基)环己烷-1, 3-二酮(10j):产率52%, 黄色油状物. 1H NMR (400 MHz, DMSO-d6) δ: 8.25 (dd, J=2.4, 1.2 Hz, 1H), 7.91 (ddd, J=8.8, 2.4, 1.2 Hz, 1H), 7.67~7.64 (m, 2H), 7.57~7.50 (m, 3H), 7.47 (dd, J=8.8, 1.2 Hz, 1H), 6.27 (dd, J=2.8, 1.8 Hz, 2H), 6.09 (d, J=1.2 Hz, 1H), 3.05 (d, J=7.6 Hz, 2H), 2.87 (d, J=15.6 Hz, 2H), 2.61 (d, J=1.2 Hz, 2H), 2.11 (dd, J=14.0, 6.4 Hz, 2H), 1.81~1.79 (m, 3H), 1.72 (t, J=7.6 Hz, 4H), 0.53 (dd, J=2.4, 1.0 Hz, 1H); 13C NMR (400 MHz, CDCl3) δ: 198.88, 174.02, 158.49, 152.85, 151.35, 131.82, 130.94, 129.62, 126.72, 122.86, 120.79, 117.55, 117.19, 105.16, 94.16, 90.12, 42.98, 42.69, 36.30, 34.53, 31.01, 23.76, 21.72, 14.76. HRMS calcd for C24H28IO4S [M+H]+ 539.0748; found 539.0742.
2-([4-(2, 6-二溴苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10k):产率57%, 黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.15 (d, J=6.4 Hz, 2H), 7.05 (s, 1H), 7.01~6.94 (m, 3H), 6.87 (d, J=6.4 Hz, 1H), 5.69 (s, 1H), 5.57 (s, 2H), 2.81 (s, 1H), 2.50 (dd, J=21.2, 14.0 Hz, 4H), 2.17 (s, 2H), 2.11~2.00 (m, 1H), 1.56 (dd, J=19.2, 11.0 Hz, 2H), 1.25 (dd, J=16.0, 9.2 Hz, 6H); 13C NMR (400 MHz, CDCl3) δ: 198.94, 174.05, 158.75, 152.85, 151.19, 130.69, 125.71, 122.72, 120.88, 120.74, 117.47, 116.38, 105.12, 90.05, 42.64, 36.46, 34.84, 30.96, 24.03, 23.71, 22.03, 14.72. HRMS calcd for C24H27Br2O4S [M+H]+ 568.9997; found 568.9990.
2-([4-(4-溴-2-氯苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10l):产率61%, 黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.56 (s, 1H), 7.26 (d, J=8.8 Hz, 1H), 6.97 (d, J=8.4 Hz, 2H), 6.91~6.85 (m, 2H), 6.72 (t, J=13.6 Hz, 1H), 5.67 (s, 1H), 5.55 (s, 2H), 2.79 (d, J=5.6 Hz, 1H), 2.49 (dd, J=23.6, 15.6 Hz, 5H), 2.20 (dd, J=15.6, 9.6 Hz, 1H), 2.11~1.97 (m, 1H), 1.67~1.47 (m, 2H), 1.34~1.17 (m, 6H); 13C NMR (400 MHz, CDCl3) δ: 199.05, 174.14, 152.72, 151.56, 133.13, 130.81, 126.18, 120.65, 120.41, 119.64, 117.53, 116.48, 115.75, 105.13, 90.10, 42.65, 36.30, 34.50, 30.90, 24.06, 23.72, 21.72, 14.75. HRMS calcd for C24H27BrClO4S [M+H]+ 525.0496; found 525.0489.
2-([4-(2-溴-4-氯苯氧基)苯氧基]甲基)-5-[2-(乙硫基)丙基]环己烷-1, 3-二酮(10m):产率51%, 黄色油状物. 1H NMR (400 MHz, DMSO-d6) δ: 7.86 (d, J=7.8 Hz, 1H), 7.69 (s, 1H), 7.57 (d, J=2.4 Hz, 1H), 7.55 (d, J=3.2 Hz, 1H), 7.47 (d, J=2.4 Hz, 1H), 7.45 (d, J=2.2 Hz, 1H), 7.39~7.36 (m, 1H), 6.17 (q, J=7.2 Hz, 2H), 5.98 (s, 1H), 3.31 (dd, J=13.6, 7.0 Hz, 1H), 3.23 (s, 1H), 2.96 (d, J=7.2 Hz, 2H), 2.75 (s, 1H), 2.47~2.46 (m, 3H), 1.99 (ddd, J=22.4, 15.6, 6.4 Hz, 2H), 1.69 (d, J=6.4 Hz, 3H), 1.61 (t, J=7.2 Hz, 3H); 13C NMR (400 MHz, CDCl3) δ: 199.06, 174.17, 153.02, 152.66, 151.54, 133.08, 128.77, 128.52, 119.94, 119.70, 117.49, 114.52, 105.04, 90.03, 42.56, 36.20, 34.41, 30.82, 23.96, 23.65, 21.69, 14.71. HRMS calcd for C24H27BrClO4S [M+H]+ 525.0496; found 525.0491.
3.2.8 室内除草活性测定方法
盆栽法(普筛):供试靶标夏季草为苘麻、反枝苋、鱧肠、马唐、稗草和狗尾草.取内径7.5 cm花盆, 装复合土[V(菜园土):V(育苗基质)=1:2]至3/4处, 直接播种上述六种杂草靶标(芽率≥85%), 覆土0.2 cm, 待杂草长至3叶期左右备用.将待测化合物溶解于N, N-二甲基甲酰胺(DMF)溶剂中, 再加入含有0.1%吐温80水溶液稀释.各化合物按照150 g a.i./ha剂量, 采用自动喷雾塔(型号: 3WPSH-700E)喷洒, 施药后, 待杂草叶面药液晾干后移入温室培养, 25天后调查化合物对杂草的抑制活性.
3.2.9 分子对接
从Protein Data Bank数据库中下载1UYS作为受体结构, 采用Sybyl 2.0构建并优化化合物10a的三维结构, 优化方法为选用Tripos力场, 先使用最陡下降法优化1000步, 再使用共轭梯度法优化1000步, 收敛条件均设置为0.01 kcal/mol.这里采用AutoDock4.2的程序进行分子对接, 活性腔的定义:以(55.631, 54.677, 57.398)为中心定义格点盒子, 大小为50×60×50, 格点间距为0.375 Å.选用拉马克遗传算法(Lamarckian Genetic Algotithm, LGA)作为配体构象搜索方法, 对接的循环步数设置为256, 所有其它没有提及的参数均使用该软件默认提供的参数[23, 24].
辅助材料(Supporting Information) 化合物10a~10m的核磁共振氢谱和碳谱电子版谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Prado, R.; Gonzdez-Gutierrez, J.; Menendez, J. Weed Sci. 2000, 48, 311. doi: 10.1614/0043-1745(2000)048[0311:RTACCI]2.0.CO;2
-
[2]
Burton, J. D.; Gronwald, J. W.; Somers, D. A.; Connelly, J. A.; Gengenbach, B. G.; Wyse, D. L. Biochem. Biophys. Res. Commun. 1987, 148, 1039. doi: 10.1016/S0006-291X(87)80236-X
-
[3]
Babczinski, P.; Fischer, R. Pestic. Sci. 1991, 33, 455. doi: 10.1002/ps.v33:4
-
[4]
Matthews, N.; Powles, S. B.; Preston, C. Pest Manage. Sci. 2000, 56, 441. doi: 10.1002/(ISSN)1526-4998
-
[5]
Burton, J. D.; Gronwald, J. W.; Keith, R. A. Pestic. Biochem. Physiol. 1991, 39, 100. doi: 10.1016/0048-3575(91)90130-E
-
[6]
Itomaso, J. M.; Brown, P. H.; Stowe, A. E. Plant Physiol. 1991, 95, 1063. doi: 10.1104/pp.95.4.1063
-
[7]
Nikolau, B. J.; Ohlrogge J. B.; Wurtele, E. S. Arch. Biochem. Biophys. 2003, 414, 211. doi: 10.1016/S0003-9861(03)00156-5
-
[8]
Mohamed, I. A.; Li, R. Z.; You, Z. G. Weed Sci. 2012, 60, 167. doi: 10.1614/WS-D-11-00111.1
-
[9]
韩金涛, 王进敏, 董宏波, 徐志红, 刘斌, 王明安, 有机化学, 2013, 33, 596. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341765.shtmlHan, J. T.; Wang, J. M.; Dong, H. B.; Xu, Z. H.; Liu, B.; Wang, M. A. Chin. J. Org. Chem. 2013, 33, 596(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341765.shtml
-
[10]
徐志红, 董宏波, 刘斌, 孔令青, 王明安, 有机化学, 2015, 35, 411. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344681.shtmlXu, Z. H.; Dong, H. B.; Liu, B.; Kong, L. Q.; Wang, M. A. Chin. J. Org. Chem. 2015, 35, 411(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344681.shtml
-
[11]
Sandra, L.; Joachim, J.; Guido, M.; Michael, K.; Thomas, S.; Bernd, W. WO 200 610 474, 2006[Chem. Abstr. 2006, 103516].
-
[12]
Coret, J. M. US 7329770, 2005[Chem. Abstr. 2005, 1335545].
-
[13]
Becker, W.; Langeluddeeke, P.; Leditschke, H. US 3954442, 1974[Chem. Abstr. 1974, 70543].
-
[14]
Loehnert, G.; Hansigk, H. D. DE 2327954, 1975[Chem. Abstr. 1975, 125068].
-
[15]
徐志红, 张涛, 王少康, 李俊凯, 有机化学, 2017, 37, 526. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345752.shtmlXu, Z. H.; Zhang, T.; Wang, S. K.; Li, J. K. Chin. J. Org. Chem. 2017, 37, 526(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345752.shtml
-
[16]
Tatao, L.; William, L. GB 2179352, 1987[Chem. Abstr. 1987, 213492].
-
[17]
Graham, J. B.; Lindsay, E. C.; Graeme, J. F.; Wendy, A. J.; Jack, L.; Alexander, S.; Richard, B. W. and Keith, G. W. Bioorg. Med. Chem. Lett. 1997, 12, 1489.
-
[18]
Kim, D. S.; Chun, S. J.; Jeon, J. J.; Lee, S. W.; Joe, G. H. Pest Manage. Sci. 2004, 60, 1007. doi: 10.1002/(ISSN)1526-4998
-
[19]
John, W.; Sandra, J.; Allan, R. US 6300281, 2001[Chem. Abstr. 2001, 741533].
-
[20]
Prem, N. M.; Michael, P.; Sammes. J. Chem. Soc., Perkin. Trans. 1988, pp. 161~168.
-
[21]
Tsutomu, K.; Kiyoshi, K.; Mikio, S. US 4355184, 1982[Chem. Abstr. 1982, 103658].
-
[22]
Bernard, L. Synth. Commun. 1992, 22, 2343. doi: 10.1080/00397919208019089
-
[23]
Morris, G. M.; Goodsell, D. S.; Halliday, R. S.; Huey, R.; Hart, W. E.; Belew, R. K.; Olson, A. J. Comput. Chem. 1998, 19, 1639. doi: 10.1002/(ISSN)1096-987X
-
[24]
Xiong, L.; Li, H.; Jiang, L. N.; Ge, J. M.; Yang, W. C.; Zhu, X. L.; Yang, G. F. J. Agric. Food Chem. 2017, 65, 1021. doi: 10.1021/acs.jafc.6b05134
-
[1]
-
表 1 化合物10a~10m苗后室内除草活性(抑制率/%)
Table 1. Post-emergence herbicidal activity (inhibition rate/%) of compounds 10a~10m
化合物 剂量/
(g a.i.·ha-1)苘麻 反枝苋 鱧肠 马唐 稗草 狗尾草 10a 150 0 70 50 0 50 0 10b 150 30 50 50 50 50 50 10c 150 0 40 50 0 30 0 10d 150 0 50 30 0 0 0 10e 150 0 60 40 30 40 0 10f 150 30 40 30 50 0 50 10g 150 30 0 30 0 30 0 10h 150 0 50 0 0 0 0 10i 150 30 20 30 0 0 20 10j 150 0 30 40 0 30 0 10k 150 0 20 30 0 0 0 10l 150 30 0 30 0 0 0 10m 150 20 0 30 0 0 20 烯草酮 150 0 0 0 100 100 100 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 11
- 文章访问数: 3310
- HTML全文浏览量: 430


 下载:
下载:


 下载:
下载:

