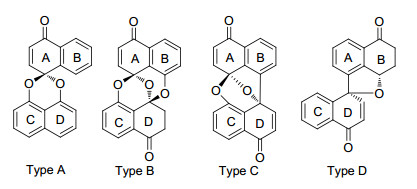
 图1
螺二萘类天然产物的结构骨架分类
Figure1.
Skeleton classfication of natural products spirobis-naphthalenes
图1
螺二萘类天然产物的结构骨架分类
Figure1.
Skeleton classfication of natural products spirobis-naphthalenes

Citation: Liu Xinlei, Zhao Yu, Wang Weiwei, Wang Ming'an, Zhou Ligang. Recent Progress of Natural Product Spirobisnaphthalenes[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2883-2894. doi: 10.6023/cjoc201705020

螺二萘类天然产物化学研究的新进展
English
Recent Progress of Natural Product Spirobisnaphthalenes
-
Key words:
- spirobisnaphthalene
- / spiroketal
- / natural product
- / synthesis
- / bioactivity
-
螺二萘(Spirobisnaphthalenes或Spirodioxyna-phthalenes)是一类由两个萘环通过螺缩酮或联二萘醚形式连在一起并高度氧化的天然产物, 他们结构新颖复杂、手性中心多, 具有广泛的生物活性, 自1989年首次分离到该类天然产物以后, 成为天然产物及合成化学家热门的研究课题. Imanishi, Zhou以及Krohn等[1~3]先后对2010年前该类天然产物的分离及结构、化合物的全合成及结构修饰、生物合成途径、生物活性以及结构-活性关系等进行了综述, 其后经历了8年多时间的发展.该类天然产物的研究依然深受关注并取得了重要的进展.为了进一步推进我国天然产物化学及先导结构优化等在新医药、新农药创制方面的研究工作, 本文结合本课题组的相关研究工作对2010年以来螺二萘类天然产物化学研究取得的新进展进行了综述, 包括新发现的螺二萘类天然产物结构、螺二萘类天然产物的全合成及结构修饰、生物合成途径、天然产物产量的调控、生物活性以及结构-活性关系等.
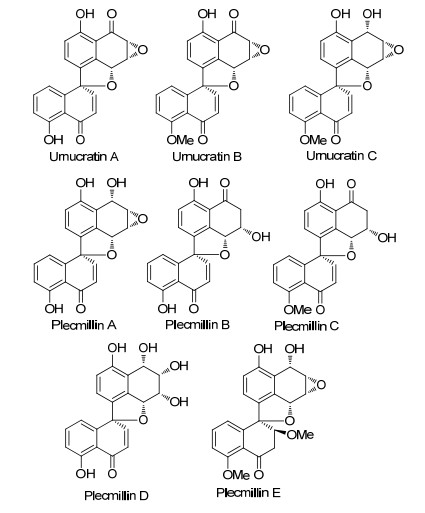
在螺二萘类化合物研究的前20年里, 主要从植物内生菌的发酵液及菌丝体中分离到了A, B, C三类化合物, 其中A类化合物的两个萘环间通过一个缩酮相连接, 主要存在A和B环上取代基不同、双键的氧化或还原、环氧键的开环、B环的去芳构化等变化, B类化合物的两个萘环间通过两个缩酮相连接, 主要存在A, C和D环上取代基不同以及D环羰基的还原等变化, 而C类化合物两个萘环间通过一个缩酮和一个碳碳σ键相连接, 主要存在A, B, C和D环上取代基不同以及A, D环羰基的还原等变化.在2012年首次分离到一类新的D类化合物, 在两个萘环间通过一个醚键和一个碳碳σ键相连接[4], 主要存在B, C和D环上取代基不同以及B环羰基的还原等变化, 他们的结构骨架见图 1.
1 新的螺二萘类天然产物
1.1 A类化合物
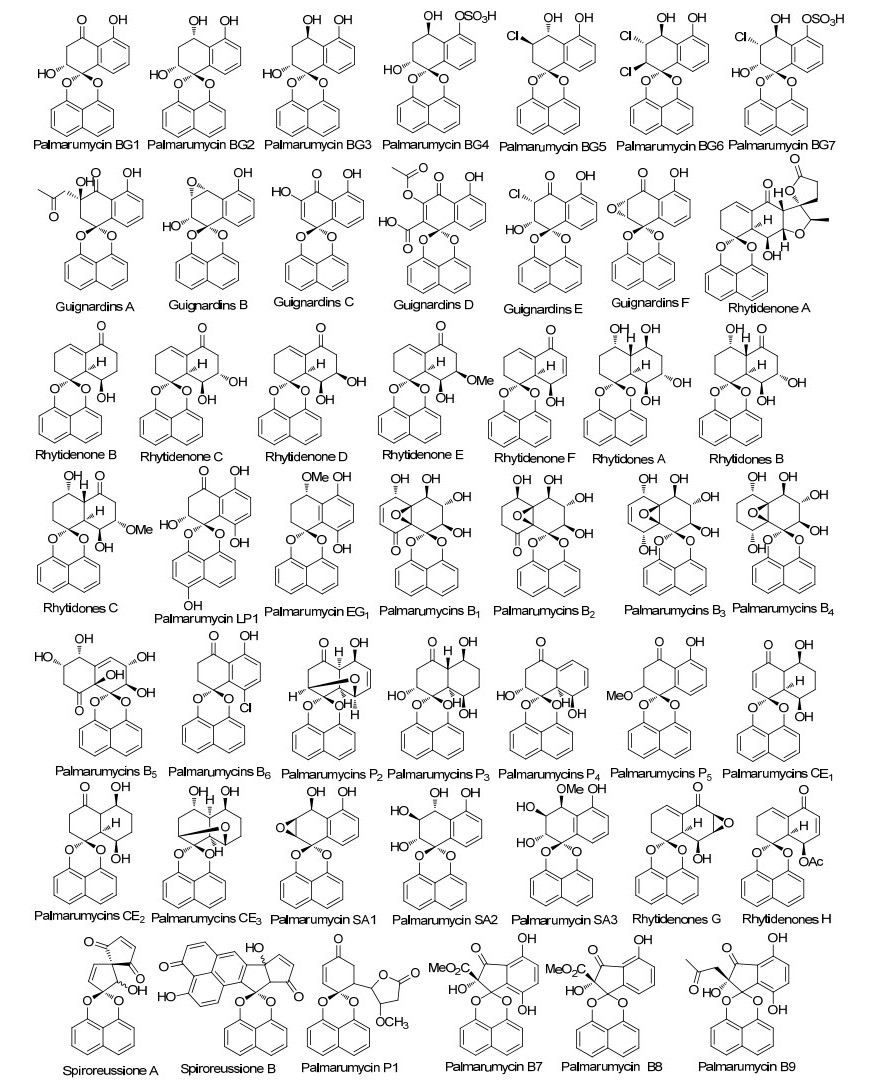
自Zhou和Krohn等[2, 3]在2010年进行了总结以后, 又相继分离鉴定了大量的A类化合物. 2011年Guo等[5]从红树属的木榄幼苗中分离得到了Palmarumycins BG1~BG7, 首次从天然产物中发现了含有磺酸基团的螺二萘类化合物Palmarumycins BG4和BG7;同年Martínez-Luis等[6]在以前工作的基础上从巴拿马的马鞭草科植物Petrea volubilis L.中的内生真菌Edenia sp. strain F0755发酵液中进行抗寄生虫和抗肿瘤活性物质的筛选, 结果只得到几个已知的该类化合物; 2013年邵泰明和Ekuadzi等[7, 8]分别从大果榕(Ficus auriculata)茎提取物和药用植物檫木(Gouania longipetala)中也分离得到了化合物Palmarumycin BG1; 2014年Ai等[9]从红树林植物Kandelia candel的新鲜果实中分离到内生真菌Guignardia sp. KcF8并从其发酵液中分离得到了6个新的螺二萘类化合物Guignardins A~F, 同时也发现了三种已知化合物Palmarumycin C1, Palmarumycin BG1和Palmarumycin JC1; 2014年Pudhom等[10, 11]从泰国红树林植物刺茉莉(Azima sarmentosa)分离到的内生真菌Rhytidhysteron sp. AS21B发酵液中提取得到9个新的化合物Rhytidenones A~F和Rhytidones A~C; 同年Lu等[12]从四川攀枝花产喜树(Camptotheca acuminate)的内生真菌Lasiodiplodia pseudotheobromae XSZ-3发酵液中分离得到了一个新的化合物palmarumycin LP1; Macías-Rubalcava等[13]从墨西哥金塔纳罗奥州的喜树(Camptotheca acuminate)树叶中的内生真菌E. gomezpompae发酵液中分离得到了一个新化合物palmarumycin EG1; 本课题组[14]在前期已有的结果基础上, 又从药用植物薯蓣(Dioscorea zingiberensis)分离的内生真菌Berkleasmium sp.的发酵液分离得到9个新化合物palmarumycins B1~B9和13个已知化合物; 2015年Li等[15]从内生真菌Guignardia sp.中分离得到了已知化合物palmarumycin C11; 2015年Bunyapaiboonsri等[16]从的红树林真菌BCC 25093中分离得到了5个新的A类型化合物Palmarumycins P1~P5; 2015年Yu等[17]在对黄花三宝木(Trigonostemon lutescens)枝条的化学成分研究时得到了少量的已知化合物Palmarumycin JC2; 2015年Gunatilaka等[18]从沙卷柏(Selaginella arenicola)的内生真菌Anteaglonium sp. FL0768中发现了3个新化合物palmarumycins CE1~CE3; 2015年Spiteller等[19]从刚果非洲楝(Entandrophragma congoense)的树皮中发现了palmarumycin C11等多种已知化合物; 2016年Jiang等[20]从马钱子的种子中分离得到了三种全新的化合物Palmarumycins SA1~SA3; 2016年Xie等[21]从青苔Parmelia sp.的内生真菌Phialocephala fortinii中提取得到四种新的palmarumycins P1~P4; 2016年Kamal等[22]从内生真菌Lasiodiplodia theobromae的中性发酵液中分离得到已知化合物cladospirone B; Pudhom等[23]在2017年通过使红树林中的内生真菌Rhytidhysteron rufulum AS21B的培养液处于一种酸性(pH≈5)的环境中培养, 从它们的次生代谢物中发现了两个新化合物Rhytidenones G和H.除此而外, 早在2006年Munro等[24]就从新西兰的蜜汁树(Knightia excels)的内生真菌培养液中分离到了具有独特结构的化合物Spiromamakone A并给出了合理的生源合成途径; 其后在2009年Chen等[25]从我国广西产土沉香树干的内生真菌Preussia sp.发酵液中分离到新化合物Spiroreussione A和Spiroreussione B, 从生源合成途径上推测Spiromamakone A和Spiroreussione A可能是同一个化合物, 需要进一步实验证实这一推断. 图 2给出了所有这一时期发现的A类新化合物48个, 可以看出他们是最主要的螺二萘类化合物.
1.2 B类化合物
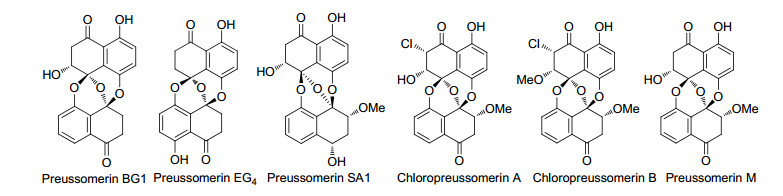
在这一时期除了Macías-Rubalcava[13], Masahiko[26]及Chen等[27]分别从不同内生菌发酵液中分离得到已知化合物preussomerins EG1~EG3, preussomerins A, C, D, F, G, H, K, M以及ymf 1029 C和ymf 1029 E外, Cai等[5]从红树属的木榄幼苗中分离得到了一个新的B类型化合物preussomerin BG1, Macías-Rubalcava等[13]从内生真菌E. gomezpompae发酵液中得到一种新化合物preussomerin EG4, Jiang等[20]从马钱子的种子中分离得到了新化合物Preussomerin SA1, Chen等[27]从内生真菌Lasiodiplodia theobromae ZJ-HQ1中分离出两个新化合物Chloropreussomerins A和B, 同时preussomerin M作为天然产物属首次报道.在这一时期只发现了6个新的B类化合物(图 3), 与A类化合物相比他们的两个萘环氧化程度均较高, 结构更为复杂, 没有发现A类化合物相似的变形情况.
1.3 D类化合物
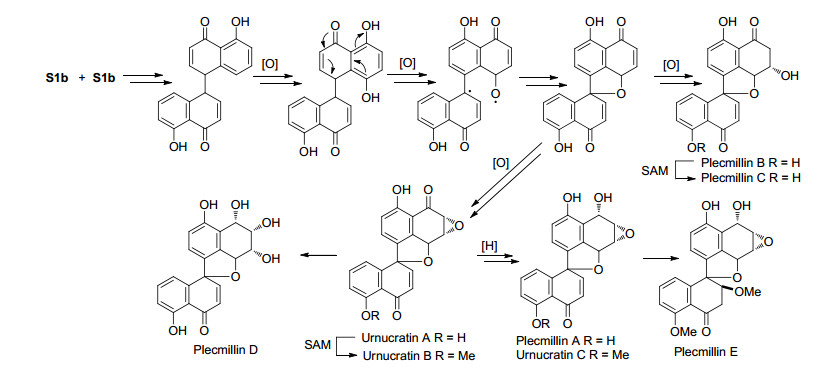
在这一时期, 除分离鉴定了大量的A和B类新化合物外, 没有获得新的C类化合物.在2012年Liu等[4]首次从北美洲的杯菌(Urnula craterium)发酵液中发现了三个新的D类型螺二萘化合物Urnucratins A~C, 其后Wang等[28]从另一种杯菌Plectania sp.发酵液中也分离得到五个新的该类化合物plecmillins A~E.到目前为此, 总共发现了8个D类型螺二萘化合物(图 4), 从结构上看, D类化合物有可能是C类化合物的生物合成前体, 但是没有明确证据.
2 螺二萘类天然产物的全合成及结构类似物
2.1 螺二萘类天然产物的全合成
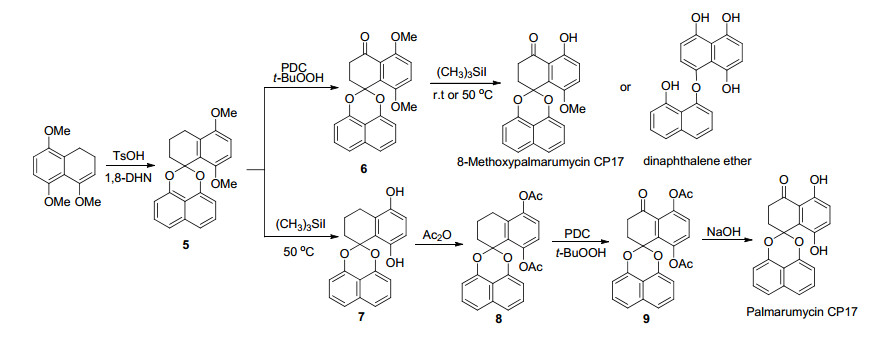
在文献[1~3]的综述中对多个结构相对简单的天然产物全合成进行了总结, 在此不再重复.由于B, C, D三类化合物高度氧化、分子中手性中心多以及分子中缩酮导致的张力较大, 对该类化合物的全合成提出了巨大的挑战, Imanishi课题组[1]早在2003年就完成了(±)-spiroxin C的全合成, 其后Erika[29]在10年前就在探索对C类化合物Spiroxin A和B的全合成研究, 至今仍没有完成工作, 因此最近几年一直没有关于B, C, D三类化合物的全合成及其结构修饰的报道, 而对A类化合物而言, 这些年也只对一些结构相对简单的分子的全合成及结构修饰进行了研究. 2010年Krohn课题组[30]通过卤代萘与对甲氧基苯酚在氧化亚铜的催化下偶联, 然后在用BBr3脱甲基以及在氧化银的氧化下环化合成关键化合物1, 然后1与共轭二烯发生Diels-Alder反应生成了螺二萘类骨架化合物2, 再经二氯二氰基苯醌(DDQ)氧化得到化合物3, 3直接经过脱甲基保护得到天然产物Palmarumycin CP1, 3经过催化氢化得到消旋的CJ-12371甲基醚, 该甲基醚再经氯铬酸吡啶(PCC)氧化得到4, 4再经脱甲基反应成功合成天然产物Palmarumycin CP2 (Scheme 1).
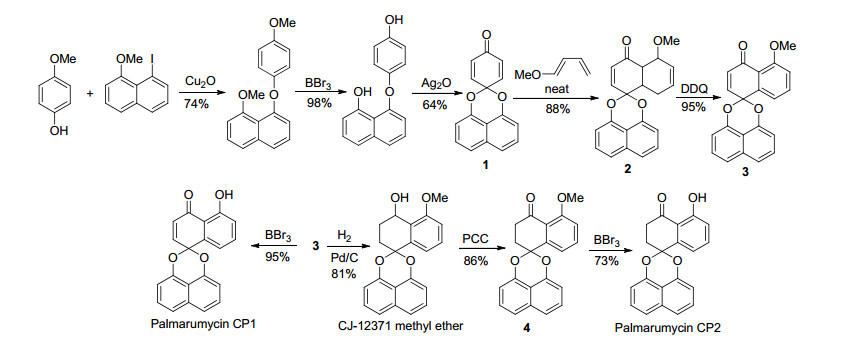 图式 1
Palmarumycins CP1, CP2和CJ-12371甲基醚的全合成
Scheme1.
Total synthesis of palmarumycins CP1, CP2 andCJ-12371 methyl ether[30]
图式 1
Palmarumycins CP1, CP2和CJ-12371甲基醚的全合成
Scheme1.
Total synthesis of palmarumycins CP1, CP2 andCJ-12371 methyl ether[30]
本课题组[14, 31]在从事药用植物薯蓣(D. zingiberensis)内生真菌Berkleasmium sp.发酵液化学成分及其生物活性评价研究的同时开展了Palmarumycin CP17的全合成研究(Scheme 2), 由于8位羟基的存在导致的位阻效应, 难以采用直接合成缩酮的方法.参考文献[1, 3]先通过将四氢萘酮转化为烯醇醚, 再与1, 8-二羟基萘缩合顺利制备了螺二萘类骨架化合物5, 然后再通过苄位氧化制得了5, 8-二甲氧基Palmarumycin CP17 (6), 当化合物6采用Me3SiI或BBr3脱去保护基时, 发现在室温时只能得到脱去一个甲基的8-甲氧基Palmarumycin CP17, 而在回流温度下反应则会发生缩酮的断裂并芳构化为二萘基醚的衍生物; 后来改变策略先将螺二萘类骨架化合物5脱保护得到双羟基化合物7, 经乙酰基保护为8, 8再经苄位氧化制得了5, 8-二乙酰氧基Palmarumycin CP17 (9), 在碱性条件下脱去乙酰基顺利地合成了Palmarumycin CP17 (Scheme 2)[31].
2.2 螺二萘类天然产物的结构类似物的合成和结构修饰
为了探索不同结构对生物活性的影响, 在进行天然产物全合成的同时不同课题组也合成了一定量的结构类似物, 在文献[1~3]中涉及到2010年前的化合物本文不再出现.在2011年Krohn课题组[32]在完成Palmarumycin CP1和CP2全合成以后, 采用类似的策略并经常规化学转化合成了大量的非天然Palmarumycin衍生物如图 5所示.本课题组[31]在完成Palmarumycin CP17全合成的同时, 除得到了Scheme 2中的5, 8-二甲氧基Palmarumycin CP17, 8-甲氧基Palmarumycin CP17, 5, 8-二乙酰氧基Palmarumycin CP17外, 为了进行生物活性的比较还采用同样的方法得到了类似物, 但是这些含甲氧基的螺二萘类化合物试图采用Me3SiI或BBr3脱去保护基时, 无一例外均发生了缩酮的断裂并芳构化为二萘基醚衍生物的反应(图 6)[31], 推断与甲氧基的位置、羰基的存在以及反应温度等因素密切相关.
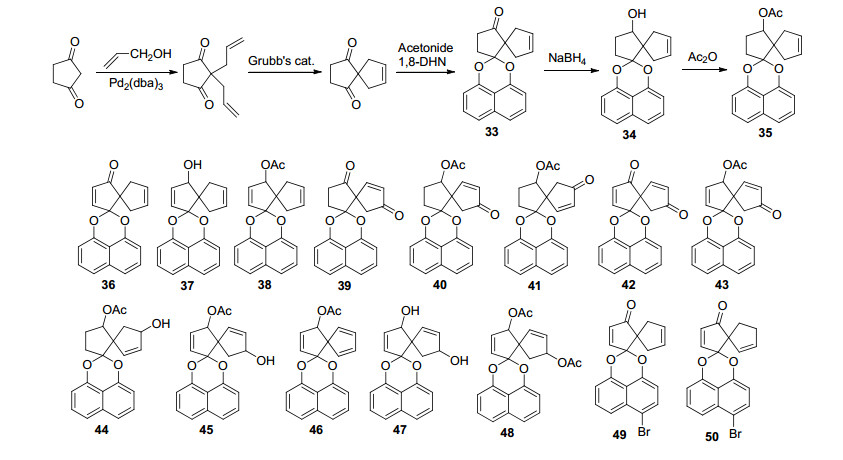
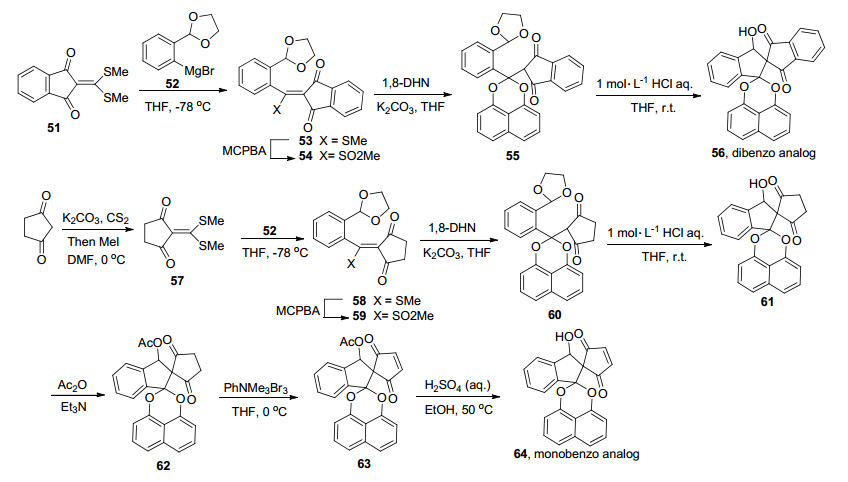
另一项工作是Munro等[24]根据天然产物spiro-mamakone A分离时总伴随着A类化合物的分离, 因此提出了spiro-mamakone A可能的生物合成过程, 后来他们通过13C同位素标记前体再进行发酵培养分离得到13C-标记spiro-mamakone A, 分析13C-标记位置及富积因子等, 他们推测这种双螺环结构是由A类型化合物Palmarumycin CP1经连续氧化裂解、脱羧及分子内羟醛缩合等转化而来, 证实最初提出的生物合成过程.在此基础上他们[33]以1, 3-环戊二酮为原料, 制备成双烯丙基化合物, 再经烯烃复分解环合得到了关键中间体螺[4, 4]-1, 4-壬二酮-6-烯, 再与1, 8-二羟基萘缩合顺利制备了spiro-mamakone A骨架化合物33, 再经过不同的转化得到了具有spiro-mamakone A骨架结构的衍生物34~50 (Scheme 3).在此基础上最近Tsukamoto等[34]通过类似策略独立完成了单苯并和双苯并spiro-mamakone A化合物合成(Scheme 4), 但是至今也没有完成spiro-mamakone A的全合成.
3 螺二萘类天然产物的生物合成途径
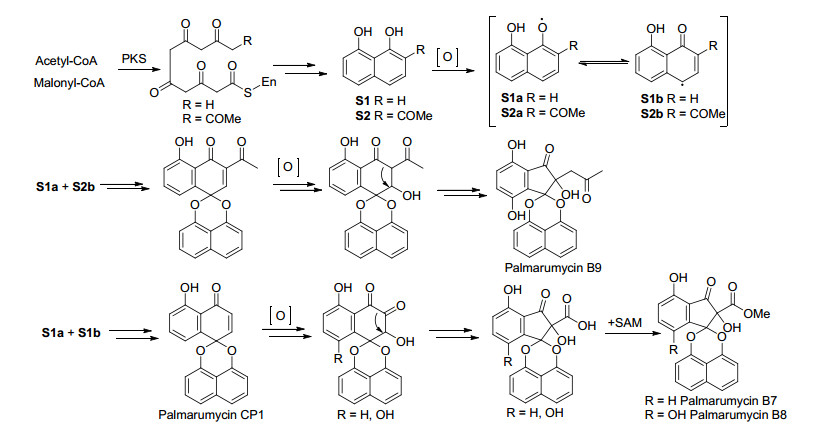
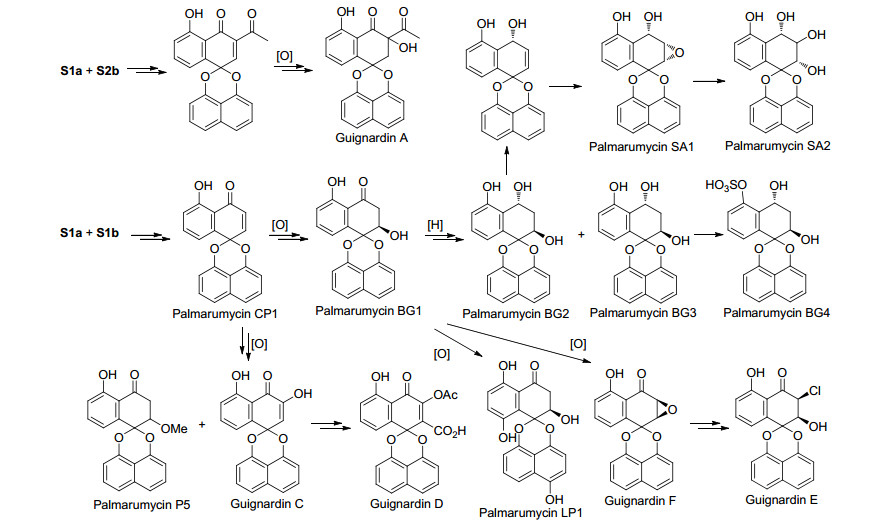
在文献[2, 3]中对Krohn课题组首先提出的天然产物Palmarumycin CP1的生物合成假设作了总结, 主要是通过聚酮途径转化为1, 8-二羟基萘, 再进一步经氧化、自由基偶联、氧化环化成缩酮得到Palmarumycin CP1, 再经生物体内的转化得到高度氧化的其他A, B, C类化合物.在此基础上, Bode等[35]对cladospirone bisepioxide的生物合成途径进行了研究, 认为Palmarumycin CP1经环氧化得到Palmarumycin C2, Palmarumycin C2进一步氧化得到Palmarumycin C3, Palmarumycin C3经还原得到Palmarumycin C12, Palmarumycin C12进一步氧化得到cladospirone bisepioxide.根据同样的聚酮合成途径, Van der Sar等[24]提出了spiro-mamakone A的生物合成假设, 后来通过同位素标记实验证实了这种假设的合理性.在2010年后尽管分离鉴定了数十个新的螺二萘类化合物, 大多数均为A和B类化合物, 原则上他们应具有上述相同的聚酮生物合成途径, Palmarumycin P1是第一个具有五元环内酯结构的螺二萘类化合物[16], 对这个化合物尚没有提出合理的生物合成途径, 而Palmarumycins B7~B9则是首次发现的具有α-羟基酯或α-羟基丙酮基取代的螺二萘类化合物, 本课题组根据萘醌类及螺二萘类化合物的结构特点, 提出了一个合理的生物合成途径(Scheme 5), 这对于开展这些化合物的仿生合成具有重要的参考意义[14], 但是这一假设需要进一步基因组学等生物学实验的证实, 相关工作正在进一步开展之中.根据上述聚酮生物合成途径, 我们课题组进一步提出了文献中尚未涉及的部分其他A类化合物的生物合成如Scheme 6所示, 这样由聚酮生物合成PalmarumycinCP1后, 经不同程度的氧化还原可以得到各种复杂的化学结构, 同样参照Heathcock等[36]提出的B类化合物的生物合成过程, 由这些A类化合物进一步氧化环化可以得到B和C类化合物, 如由Palmarumycin LP1氧化环化可以得到Preussomerin BG1等, 在此不再继续讨论.尽管最新分离得到的D类化合物尚未有人推断他们的生物合成途径及试验证实, 作者根据聚酮生物合成途径以及Krohn在文献[3]提出的不同螺二萘类化合物的生物合成间的关系, 提出D类化合物可能的生物合成途径如Scheme 7所示.最近Ai等[37]从红树林植物Kandelia candel分离的内生真菌Cladosporium sp. KcFL6中分离到二聚萘酮化合物Cladosporone A, 进一步证明上述生物合成途径是合理的.
4 调控微生物发酵液中螺二萘类化合物产量的方法
无论是植物还是微生物发酵液中螺二萘类化合物的含量都是较低的, 鉴于该类化合物具有广泛的生物活性, 近年来也开展了调控微生物发酵液中螺二萘类化合物产量的方法研究, 周立刚课题组[38~48]开展了大量研究工作. 2011年Zhao等[38]发现向内生真菌Berklea-smium sp. Dzf12的培养液加入酵母提取液的多糖馏分和非糖馏分可以提高菌丝的生长和天然产物diepoxin ζ的产量, 实验结果表明, 在第三天向培养液中加入10 g/L的酵母萃取物后再培养10 d可以使diepoxin ζ的产量最高提高至3.2倍, 进一步还发现提取液的多糖部分主要是能提高化合物diepoxin ζ的产量, 而非糖部分主要是能促进菌丝的生长; 2011年Zhao等[39]又利用原位树脂吸附法在内生真菌Berkleasmium sp. Dzf12菌丝培养基中加入树脂AB-8, 可有效提高化合物diepoxin ζ的产量最高可达1.4倍; Li等[40]后来通过将从寄主植物薯蓣提取的水溶性多糖、酸溶性多糖和碱溶性多糖分别添加到内生真菌Berkleasmium sp. Dzf12菌丝培养液中, 发现水溶性多糖可以使diepoxin ζ的产量提高到2.69倍.另一方面Mou等[41]从内生真菌Berkleasmium sp.中分离得到了palmarumycins C2和C3, 后来发现通过添加1-十六碳烯可以使palmarumycins C2和C3的产量分别提高40和59.5倍; Zhao等[42]也通过在内生真菌Berkleasmium sp. Dzf12的培养液中添加葡萄糖、蛋白胨和酵母提取物等来改善palmarumycin C13的积累量, 最优条件下使palmarumycin C13的产量提高2.5倍; 同时还研究了八种金属离子对Berkleasmium sp. Dzf12的菌丝培养以及palmarumycins C12和C13产量的影响, 结果研究表明当分别添加一定量的Ca2+, Cu2+和Al3+离子时能够使palmarumycins C12和C13的最大产量提高3.94, 4.19和4.49倍[43]; 2012年Li等[44]从通过将从寄主植物薯蓣根茎中提取得到三种多糖提取物, 并分别水解得到对应的寡糖, 使用这三种寡糖分别添加到内生真菌Berkleasmium sp. Dzf12的培养液中, 他们发现这些寡糖能够使内生真菌培养液中的palmarumycins C12和C13产量分别提高至9.83和3.24倍; 进一步的研究发现大孔吸附树脂对Berkleasmium sp. Dzf12培养液中的Palmarumycins C12和C13积累也有显著的影响, 实验结果表明在发酵液中添加一定量的大孔吸附树脂能够有效地提高Palmarumycins C12和C13积类作用从而提高产量[45, 46]; Mou等[47]同时还通过向内生真菌Berkleasmium sp. Dzf12的培养液中添加具有生物相容性的5%油酸丁酯能同时有效地提高Palmarumycins C12和C13的产量, 添加10%的液体石蜡只能够有效提高Palmarumycin C13的产量; 进一步研究还发现在内生真菌的培养液中直接添加Palmarumycin C13进行诱导也可以有效提高Palmarumycin C13的产量[48].
其他课题组也有关于这方面的研究, 如2014年Cubilla-Ríos等[49]为了提高内生真菌Edenia sp.中Palmarumycin CP18的产量, 研究了在培养基中通过添加固体介质来提高Palmarumycin CP18产量的方法, 发现这些固体介质均未起到明显作用, 但是添加了马铃薯葡萄糖琼脂的培养基中可以导致Palmarumycin CP18的生物前体化合物CJ-12, 372的大量产生, 而CJ-12, 372可以人工使用二氯二氰基苯醌(DDQ)氧化为Palmarumycin CP18; Chen等[50]为了提高内生真菌Preussia sp.中Spiropreussione A的产量, 通过调整内生真菌Preussia sp.的培养基条件, 优化了天然产物Spiropreussione A的产量, 比优化前提高了46.5%;同时他们[51]通过向内生真菌的培养液中加入大孔树脂AB-8可以使Spiropreussione A的产量提高至2.5倍, 并可利用其吸附作用来加快Spiropreussione A分离纯化进程.
5 螺二萘类化合物的生物活性及结构-活性关系
在文献[2, 3]中对Zhou及Krohn课题组分别对2010年前该类化合物的生物活性以及结构-活性关系等进行了总结, 这类化合物主要具有对革兰氏阴性菌、革兰氏阳性菌、大肠杆菌、葡萄球菌等具有显著的抗菌活性, 对稻瘟病菌、葡萄单轴霉菌、镰刀霉菌、小麦叶锈病菌等植物病原菌也具有良好的杀菌活性, 对HT-1080, A549和Jurkat多种肿瘤细胞或癌细胞具有显著细胞毒活性, 对法尼基蛋白转移酶、DNA拓扑异构酶和DNA旋转酶以及植物生长等也具有良好的抑制活性, 这些内容本文也不再讨论, 其后发现的许多新化合物也显示出多种多样的生物活性.
5.1 螺二萘类天然产物的抗菌活性
2009年本课题组[52]报道从内生菌Berkleasmium sp. Dzf12发酵液中分离得的Diepoxin η和Diepoxin ζ的混合物以及Diepoxin κ对大肠杆菌、根瘤土壤杆菌、番茄疮痂病菌、黄瓜角斑病菌、枯草芽孢杆菌等有较好的抑制活性, 并与分子中存在的环氧基团结构密切相关; 通过使用多孔板-噻唑蓝(MTT)比色法测定了diepoxin ζ对稻瘟病菌的IC50和最小抑制浓度值(MIC)分别为96.21和200 μmol•L-1[53]; 进一步研究结果表明palmarumycin C8对多种细菌和真菌都具有一定的抑制作用[14]; 本文作者[31]对合成的palmarumycin CP17及其类似物的抑制植物病原菌活性进行了测试, 发现两个化合物对苹果轮纹病菌的EC50值分别为9.34和12.35 µg/mL, 一个化合物对水稻立枯病菌的EC50值为11.18 µg/mL, 结构-活性关系研究结果显示, 4-羰基或羟基对抗菌活性具有至关重要的作用, 而脱去甲氧基或乙酰基将大大减弱抗菌活性, 在8-羟基或甲氧基对抗菌活性没有显著影响. 2012年Liu等[4]对新发现的D类化合物Urnucratins A~C进行了生物活性测试, 发现Urnucratins A对耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌和酿脓链球菌具有较好的抑制活性, MIC值分别为2, 1和0.5 μg/mL; Chen等[27]发现Chloropreussomerin A, Chloropreussomerin B, preussomerin H, preussomerin G, preussomerin F和preussomerin A对金黄色葡萄球菌表现出较明显的抑制活性, MIC值在1.6~13 μg/mL之间; Wang等[28]对D类化合物plecmillins A~E和Urnucratin C进行生物活性测试, 发现plecmillins A~E对耐甲氧西林金黄色葡萄球菌和枯草芽孢杆菌均具有一定的抑制活性, MIC值为1.9~7.8 μmol•L-1.
5.2 螺二萘类天然产物的细胞毒活性
2008年Murphy等[33]发现所有合成的spiro-mamakone A类似物对P388细胞的细胞毒活性都不及天然产物, 可能是他们均破坏了原有分子中的4-环戊烯-1, 3-二酮所致. 2009年Chen等[25]对Spiroreussione A和Spiroreussione B进行生物活性测试, 发现化合物Spiroreussione A对卵巢癌细胞A2780和人肝癌细胞BEL-7404具有良好的抑制作用, 其IC50值分别为2.4和3.0 µmol•L-1; 2011年Cai等[5]发现新化合物Palmarumycins BG5对人类乳腺肿瘤细胞MCF-7和人类早幼粒肿瘤细胞HL 60表现出良好抑制活性, 其对MCF-7的IC50为7.6 μmol•L-1, 对HL 60的IC50为3.1 μmol•L-1; Shan等[14]的研究结果表明diepoxin δ和palmarumycin C8对五种人类癌细胞具有较好的细胞毒活性, IC50值的范围在1.28~5.83 μmol•L-1; 2014年Pudhom等[10]的研究结果表明rhytidone C, MK3018和palmarumycin CR1对人乳腺癌细胞MCF-7和人宫颈癌细胞CaSki具有一定的细胞毒活性, 对MCF-7和CaSki细胞的IC50值分别为17.30, 20.10, 14.47和24.44, 25.59, 21.95 μmol•L-1, 而rhytidone B对CaSki细胞的IC50值为22.81 μmol•L-1; 2014年Lu等[12]发现palmarumycin LP1, Sch 50676和cladospirone B对人白血病细胞具有较好的活性, IC50值分别为2.39, 1.41和10.91 μmol•L-1; 2015年Spiteller等[19]也发现palmarumycin C11对大鼠骨骼肌成肌细胞有较弱的细胞毒活性, IC50值为25.7 μmol•L-1; Gunatilaka等[18]研究发现palmarumycins CP1和CP3对人类尤文氏肉瘤CHP-100细胞具有很强的细胞毒活性, 其IC50值分别为0.5和1.6 μmol•L-1; Masahiko等[26]也发现化合物preussomerin C和ymf 1029C具有一定的细胞毒活性; 2016年Chen等[27]发现化合物Chloro-preussomerins A和B对人类癌细胞A549和MCF-7具有较好的细胞毒活性, IC50值分别为5.9和8.9 μmol•L-1; 而preussomerin K, preussomerin H, preussomerin G和preussomerin F对人类癌细胞A549, HepG2和MCF-7表现出明显的生物活性, IC50值都在2.5~9.4 μmol•L-1之间; Tsukamoto等[34]发现合成的双苯并spiro-mamakone A类似物及其中间体对Hela细胞的细胞毒活性远低于天然产物spiro-mamakone A, 而单苯并spiro-mamakone A的细胞毒活性优于天然产物本身, 证明分子中的4-环戊烯-1, 3-二酮片段对活性是至关重要的; 2017年Pudhom等[23]针对这类天然产物对拉莫斯淋巴瘤(Ramos lymphoma)和非小细胞肺癌(drug resistant NSCLC H1975)的细胞毒活性进行了评估, 发现rhytidenone H和rhytidenone F活性最好, 它们对拉莫斯淋巴瘤的IC50值分别为0.018和0.048 μmol•L-1, 对非小细胞肺癌的IC50值分别为0.252和1.17 μmol•L-1.
5.3 螺二萘类天然产物的抗虫和杀虫活性
Martinez-Luis等[54, 55]最先报道了palmarumycin CP2, palmarumycin CP17, palmarumycin CP18和CJ-12, 371等化合物对引起利氏曼病的利氏曼原虫的拮抗活性, 此后2011年他们[6]进一步测试了包括palmarumycin CP19和preussomerin EG1在内的多个化合物的抗利氏曼虫活性, IC50值依次为3.93, 1.34, 0.62, 8.40, 11.6和0.12 μmol• L-1, 发现具有8位羟基的palmarumycin CP17, palmarumycin CP18和preussomerin EG1具有更好的活性, Cubilla-Ríos等[49]的结果也证明palmarumycin CP18具有显著抗利氏曼原虫活性. 2008年Dong以及周永平等[56, 57]首次发现ymf 1029 A~E, preussomerins C, D和E等化合物对线虫(Panagrellus redivivus和Bursaphelen-chus xylophilus)具有一定的杀虫活性, 在100~200 μg/mL浓度之间, 致死率最高达83.7%. 2015年Bunyapaiboonsri等[16]研究首先发现Palmarumycin P1, decaspirone A, palmarumycin CP3和palmarumycin CP4表现出抗疟原虫活性, 对镰状疟原虫K1的IC50值依次为2.36, 2.30, 2.28和2.23 μg/mL; 同年Spiteller等[19]发现palmarumycin C11对镰状疟原虫(Plasmodium falciparum NF54)具有一定的抗疟活性, IC50为24.5 μmol•L-1. 2016年Kamal等[22]发现cladospirone B对布氏锥虫(Trypanosoma brucei)的最小抑制浓度为17.8 μmol•L-1. 2016年Tian等[58]则发现含有氯原子的palmarumycin B6和palmarumycin C8对白纹伊蚊的四龄幼虫有一定的杀虫活性, 其LC50值分别为11.51和8.83 μg/mL, 而其它不含氯的化合物没有明显活性, 表明氯原子取代对该类化合物的杀虫活性具有至关重要的作用.
5.4 螺二萘类天然产物的其他生物活性
早在2008年Macías-Rubalcava等[59]就发现内生真菌E. gomezpompae提取物及其分离到的化合物具有一定的化感作用, 2014年他们[13]进一步研究了内生真菌E. gomezpompae菌丝体及其分离到的palmarumycins EG1, CP2, CP17, CP19和preussomerins EG1~EG4对种子萌发、根系生长和幼苗时期的生长具有显著抑制作用, 通过增加植物细胞内线粒体的耗氧量导致生长受到抑制, 他们[60]进一步深入研究发现preussomerins EG1, EG4, palmarumycins CP17和CP2主要作用于光合作用系统PSII, 通过电子传递过程中的水解酶和受体位点结合这两种途径来抑制光合作用中ATP的形成, 从而抑制植物生长. 2014年Ai等[9]发现Guignardin C对人蛋白质酪氨酸磷酸酶1B和组蛋白脱乙酰酶沉默信息调节剂T1酶(SIRT1)具有显著抑制活性, 对SIRT1的IC50为50.81 μmol•L-1, 这是治疗糖尿病的两个关键靶标. 2014年Pudhom等[10]还发现Rhytidenones C和D对吞噬细胞产生重要信号分子一氧化氮的过程有良好的抑制作用, IC50值分别为0.31和3.60 μmol•L-1, 2016年Jiang等[20]也发现Palmarumycin SA1, palmarumycin C11和preussomerin C对小胶质细胞(BV-2)中脂多糖诱导产生一氧化氮的IC50值分别为4.85, 2.05和1.86 μmol•L-1. 2015年Gocer等[61]还发现合成的螺二萘类化合物对两种人类金属蛋白酶碳酸酐酶(Carbonic Anhydrase, CA)HCAI和HCAII具有显著的抑制作用, 其Ki值介于0.39~460.42 µmol•L-1, 业已证明这类碳酸酐酶与人类的许多疾病密切相关, 开展其抑制剂的研究已成为近年来药物化学的热门领域[62].
6 结论
对2010年以来新发现的螺二萘类天然产物、该类化合物的全合成及结构修饰、生物合成途径、微生物发酵过程的调控、生物活性及其结构-活性关系等进行了综述, 随着生物学家对螺二萘类化合物合成基因簇及其调控机制的逐步阐明, 由化学家与生物学家联合起来进一步开展有关螺二萘类化合物的组合生物合成研究, 在将来一定会发现更多的化学结构多样性的该类天然产物, 并开展多样性的结构优化和生物活性评价, 获得具有广泛应用前景的潜在药物或先导化合物, 因此这一领域会受到越来越多的天然产物化学家、合成化学家和药物化学家的关注.
-
-
[1]
Miyashita, K.; Imanishi, T. Chem. Rev. 2005, 105, 4515. doi: 10.1021/cr040613k
-
[2]
Zhou, L.; Zhao, J.; Shao, T.; Cai, X.; Peng, Y. Mini-Rev. Med. Chem. 2010, 10, 977. doi: 10.2174/138955710792007178
-
[3]
Cai, Y. S.; Guo, Y. W.; Krohn, K. Nat. Prod. Rep. 2010, 27, 1840. doi: 10.1039/c0np00031k
-
[4]
Liu, X.-T.; Schwan, W. R.; Volk, T. J.; Rott, M.; Liu, M.; Huang, P.; Liu, Z.; Wang, Y.; Zitomer, N. C.; Sleger, C.; Hartsel, S.; Monte, A.; Zhang, L. J. Nat. Prod. 2012, 75, 1534. doi: 10.1021/np300221a
-
[5]
Cai, Y. S.; Kurtan, T.; Miao, Z. H.; Mandi, A.; Istvan, K.; Liu, H. L.; Ding, J.; Guo, Y. W. J. Org. Chem. 2011, 76, 1821. doi: 10.1021/jo1024877
-
[6]
Martínez-Luis, S.; Cherigo, L.; Higginbotham, S.; Arnold, E.; Spadafora, C.; Ibañez, A.; Gerwick, W. H.; Cubilla-Rios, L. Int. Microbiol. 2011, 14, 95. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3375117/
-
[7]
邵泰明, 宋小明, 陈光英, 韩长日, 郑彩娟, 姚国贵, 中草药, 2013, 44, 2208. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Shao, T.; Song, X.; Chen, G.; Han, C.; Zheng, C.; Yao, G. Chin. Tradit. Herb. Drugs 2013, 44, 2208(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[8]
Ekuadzi, E.; Dickson, R. A.; Fleischer, T. C.; Amponsah, I. K.; Pistorius, D.; Oberer, L. J. Nat. Prod. 2014, 28, 1210. doi: 10.1080/14786419.2014.921685
-
[9]
Ai, W.; Wei, X.; Lin, X.; Sheng, L.; Wang, Z.; Tu, Z.; Yang, X.; Zhou, X.; Li, J.; Liu, Y. Tetrahedron 2014, 70, 5806. doi: 10.1016/j.tet.2014.06.041
-
[10]
Pudhom, K.; Teerawatananond, T. J. Nat. Prod. 2014, 77, 1962. doi: 10.1021/np500068y
-
[11]
Pudhom, K.; Teerawatananond, T.; Chookpaiboon, S. Mar. Drugs 2014, 12, 1271. doi: 10.3390/md12031271
-
[12]
Lu, X.; Chen, G.; Li, Z.; Zhang, Y.; Wang, Z.; Rong, W.; Pei, Y.; Pan, H.; Hua, H.; Bai, J. Helv. Chim. Acta 2014, 97, 1289. doi: 10.1002/hlca.201300436
-
[13]
Macías-Rubalcava, M. L.; Ruiz-Velasco, Sobrino, M. E.; Meléndez-González, C.; Hernández-Ortega, S. J. Agric. Food Chem. 2014, 62, 3553. doi: 10.1021/jf500965k
-
[14]
Shan, T.; Tian, J.; Wang, X.; Mou, Y.; Mao, Z.; Lai, D.; Dai, J.; Peng, Y.; Zhou, L.; Wang, M. J. Nat. Prod. 2014, 77, 2151. doi: 10.1021/np400988a
-
[15]
Li, T.-X.; Yang, M.-H.; Wang, X.-B.; Wang, Y.; Kong, L.-Y. J. Nat. Prod. 2015, 78, 2511. doi: 10.1021/acs.jnatprod.5b00008
-
[16]
Bunyapaiboonsri, T.; Yoiprommarat, S.; Nopgason, R.; Intereya, K.; Suvannakad, R.; Sakayaroj, J. Tetrahedron 2015, 71, 5572. doi: 10.1016/j.tet.2015.06.061
-
[17]
Yu, H.; Bai, H.; Mei, W.; Zuo, W.; Wang, H.; Yang, J.; Dai, H. J. Trop. Subtrop. Bot. 2015, 23, 323.
-
[18]
Xu, Y.; Mafezoli, J.; Oliveira, M. C. F.; Jana, M. U.; Arnold, A. E.; Gunatilaka, A. A. L. J. Nat. Prod. 2015, 78, 2738. doi: 10.1021/acs.jnatprod.5b00717
-
[19]
Happi, G.; Kouama, S. F.; Talontsi, F.; Zühlke, S.; Lamshöft, M.; Spiteller, M. Fitoterapia 2015, 102, 35. doi: 10.1016/j.fitote.2015.01.018
-
[20]
Jiang, H.; Ma, S.-G.; Li, Y.; Liu, Y.-B.; Li, L.; Qu, J.; Yu, S.-S. Bioorg. Med. Chem. Lett. 2016, 26, 4832. doi: 10.1016/j.bmcl.2016.08.019
-
[21]
Xie, F.; Chang, W.; Zhang, M.; Li, Y.; Li, W.; Shi, H.; Zheng, S.; Lou, H. Sci. Rep. 2016, 6, 33687. doi: 10.1038/srep33687
-
[22]
Kamal, N.; Viegelmann, C. V.; Clements, C. J.; Edrada-Ebel, R. Planta Med. 2016, 83, 565. doi: 10.1055/s-0042-118601
-
[23]
Siridechakorn, I.; Yue, Z.; Mittraphab, Y.; Lei, X.; Pudhom, K. Bioorg. Med. Chem. 2017, 25, 2878. doi: 10.1016/j.bmc.2017.02.054
-
[24]
(a) Van der Sar, S. A.; Blunt, J. W.; Munro, M. H. G. Org. Lett. 2006, 8, 2059.
(b) Van der Sar, S. A.; Lang, G.; Mitova, M. I.; Blunt, J. W.; Cole, A. L. J.; Cummings, N.; Ellis, G.; Munro, M. H. G. J. Org. Chem. 2008, 73, 8635. -
[25]
Chen, X.; Shi, Q.; Lin, G.; Guo, S.; Yang, J. J. Nat. Prod. 2009, 72, 1712. doi: 10.1021/np900302w
-
[26]
Masahiko, I.; Panida, C.; Pranee, R.; Kitlada, S.; Prasert, S.; Palangpon, K.; Samran, P. J. Antibiot. 2015, 68, 334. doi: 10.1038/ja.2014.153
-
[27]
Chen, S.; Chen, D.; Cai, R.; Cui, H.; Long, Y.; Lu, Y.; Li, C.; She, Z. J. Nat. Prod. 2016, 79, 2397. doi: 10.1021/acs.jnatprod.6b00639
-
[28]
Wang, K.; Bao, L.; Ma, K.; Qi, W.; Song, F.; Yao, Y.; Yin, W.; Zhang, L.; Huang, Y.; Han, J.; Liu, H. Eur. J. Org. Chem. 2016, 25, 4338.
-
[29]
Erika, E. E. Ph.D Dissertation, University of Pittsburgh, USA, 2008.
-
[30]
Krohn, K.; Wang, S.; Ahmed, I.; Altun, S.; Aslan, A.; Florke, U.; Kock, I.; Schlummer, S. Eur. J. Org. Chem. 2010, 4476. doi: 10.1002/ejoc.201000562/full
-
[31]
Wang, R.; Liu, G.; Yang, M.; Wang, M.; Zhou, L. Molecules 2016, 21, 600. doi: 10.3390/molecules21050600
-
[32]
Aslan, A.; Altun, S.; Ahmed, I.; Florke, U.; Schulz, B.; Krohn, K. Eur. J. Org. Chem. 2011, 1176. doi: 10.1002/ejoc.201001503/full
-
[33]
Murphy, A. C.; Devenish, S. R. A.; Muscroft-Taylor, A. C.; Blunt, J. W.; Munro, M. H. G. Org. Biomol. Chem. 2008, 6, 3854. doi: 10.1039/b812263f
-
[34]
Tsukamoto, H.; Hanada, S.; Kumasaka, K.; Kagaya, N.; Izumikawa, M.; Shinya, K.; Doi, T.; Org. Lett. 2016, 18, 4848. doi: 10.1021/acs.orglett.6b02328
-
[35]
Bode, H. B.; Wegner, B.; Zeeck, A. J. Antibiot. 2000, 53, 153. doi: 10.7164/antibiotics.53.153
-
[36]
Chi, S.; Heathcock, C. H. Org. Lett. 1999, 1, 3. doi: 10.1021/ol990020+
-
[37]
Ai, W.; Lin, L.; Wang, Z.; Lu, X.; Mangaladoss, F.; Yang, X.; Zhou, X.; Tu, Z.; Liu, Y. J. Antibiot. 2015, 68, 213. doi: 10.1038/ja.2014.126
-
[38]
Zhao, J.; Zheng, B.; Li, Y.; Shan, T.; Mou, Y.; Lu, S.; Li, P.; Zhou, L. Molecules 2011, 16, 847. doi: 10.3390/molecules16010847
-
[39]
Zhao, J.; Li, Y.; Shan, T.; Mou, Y.; Zhou, L. World J. Microbiol. Biotechnol. 2011, 27, 2753. doi: 10.1007/s11274-011-0750-2
-
[40]
Li, Y.; Li, P.; Mou, Y.; Zhao, J.; Shan, T.; Ding, C.; Zhou, L. World J. Microbiol. Biotechnol. 2012, 28, 1407. doi: 10.1007/s11274-011-0940-y
-
[41]
Mou, Y.; Meng, J.; Fu, X.; Wang, X.; Tian, J.; Wang, M.; Peng, Y.; Zhou, L. Molecules 2013, 18, 15587. doi: 10.3390/molecules181215587
-
[42]
Zhao, J.; Wang, X.; Sun, W.; Mou, Y.; Peng, Y.; Zhou, L. Electron. J. Biotechnol. 2013, 16, 1. doi: 10.2225/vol16-issue6-fulltext-10
-
[43]
Mou, Y.; Luo, H.; Mao, Z.; Shan, T.; Sun, W.; Zhou, K.; Zhou, L. Int. J. Mol. Sci. 2013, 14, 979. doi: 10.3390/ijms14010979
-
[44]
Li, Y.; Shan, T.; Mou, Y.; Li, P.; Zhao, J.; Zhao, W.; Peng, Y.; Zhou, L.; Ding, C. Molecules 2012, 17, 3761. doi: 10.3390/molecules17043761
-
[45]
牟燕, 周开谊, 徐丹, 于瑞婷, 李京, 岳阳, 周立刚, 天然产物研究与开发, 2015, 27, 205. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Mou, Y.; Zhou, K.; Xu, D.; Yu, R.; Li, J.; Yue, Y.; Zhou, L. Nat. Prod. Res. Dev. 2015, 27, 205(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[46]
Mou, Y.; Li, J.; Zhou, K.; Yu, R.; Xu, D.; Luo, H.; Lai, D.; Zhou, L. Trop. J. Pharm. Res. 2015, 14, 407. doi: 10.4314/tjpr.v14i3.8
-
[47]
Mou, Y.; Xu, D.; Mao, Z.; Dong, X.; Lin, F.; Wang, A.; Lai, D.; Zhou, L.; Xie, B. Molecules 2015, 20, 20320. doi: 10.3390/molecules201119700
-
[48]
Mou, Y.; Zhou, K.; Xu, D.; Yu, R.; Li, J.; Yin, C.; Zhou, L. Trop. J. Pharm. Res. 2015, 14, 241. doi: 10.4314/tjpr.v14i2.8
-
[49]
Ortega, H. E.; Teixeira, E. M.; Rabello, A.; Higginbotham, S.; Cubilla-Ríos, L. Nat. Chem. Commun. 2014, 9, 95. http://www.ncbi.nlm.nih.gov/pubmed/24660473
-
[50]
Chen, X.; Shi, Q.; Wang, C.; Li, B.; Wang, A.; Guo, S. Mycosys-tema 2013, 32, 729. http://en.cnki.com.cn/Article_en/CJFDTOTAL-JWXT201002011.htm
-
[51]
Li, B.; Wang, C.; Chen, X.; Lyu, J.; Guo, S. J. Chromatogr. B 2013, 938, 1. doi: 10.1016/j.jchromb.2013.08.004
-
[52]
Cai, X.; Shan, T.; Li, P.; Huang, Y.; Xu, L.; Zhou, L.; Wang, M.; Jiang, W. Nat. Prod. Commun. 2009, 4, 1469. http://www.ncbi.nlm.nih.gov/pubmed/19967975
-
[53]
钟灵允, 王兰, 单体江, 刘浩, 赵江林, 徐梁, 周立刚, 天然产物研究与开发, 2012, 24, 20. doi: 10.3969/j.issn.1001-6880.2012.01.006Zhong L.; Wang L.; Shan T.; Liu H.; Zhao J.; Xu L.; Zhou L. Nat. Prod. Res. Dev. 2012, 24, 20(in Chinese). doi: 10.3969/j.issn.1001-6880.2012.01.006
-
[54]
Martinez-Luis, S.; Della-Togna, G.; Coley, P.; Kursar, T.; Gerwick, W.; Cubilla-Rios, L. J. Nat. Prod. 2008, 71, 2011. doi: 10.1021/np800472q
-
[55]
Martinez-Luis, S.; Della-Togna, G.; Coley, P.; Kursar, T.; Gerwick, W.; Cubilla-Rios, L. Rev. Latinoam. Quim. 2009, 37, 104. http://www.ncbi.nlm.nih.gov/pubmed/19007286
-
[56]
Dong, J.; Song, H.; Li, J.; Tang, Y.; Sun, R.; Wang, L. J. Nat. Prod. 2008, 71, 952. doi: 10.1021/np800034g
-
[57]
周永平, 申开泽, 董锦艳, 王利梅, 孙蓉, 王纯仁, 王乐, 张克勤, 中国抗生素杂志, 2009, 34, 74. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Zhou, Y.; Shen, K.; Dong, J.; Wang, L.; Sun, R.; Wang, C.; Wang, L. Zhang, K. Chin. J. Antibiot. 2009, 34, 74(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[58]
Tian, J.; Liu, X.; Liu, Z.; Lai, D.; Zhou, L. Pest Manage. Sci. 2016, 72, 961. doi: 10.1002/ps.2016.72.issue-5
-
[59]
Macías-Rubalcava, M. L.; Ruiz-Velasco, Sobrino, M. E.; Meléndez-González, C.; King-Díaz, B.; Lotina-Hennsen, B. J. Photochem. Photobiol. B 2014, 138, 17. doi: 10.1016/j.jphotobiol.2014.05.003
-
[60]
Macías-Rubalcava, M. L.; Hernández-Bautista, B. E.; Jemenez-Estrada, M.; Gonzalez, M. C.; Glenn, A. E.; Hanlin, R. T.; Hernández-Ortega, S.; Saucedo-Garcia, A.; Muria-Ganzalez, J. M.; Anaya, A. L. Phytochemistry 2008, 69, 1185. doi: 10.1016/j.phytochem.2007.12.006
-
[61]
Gocer, H.; Aslan, A.; Gulcin, I.; Supuran, C. T. J. Enzyme Inhib. Med. Chem. 2015, 31, 503.
-
[62]
Arabaci, B.; Gulcin, I.; Alwasel, S. Molecules 2014, 19, 10103. doi: 10.3390/molecules190710103
-
[1]
-
图式 1 Palmarumycins CP1, CP2和CJ-12371甲基醚的全合成
Scheme 1 Total synthesis of palmarumycins CP1, CP2 andCJ-12371 methyl ether[30]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 25
- 文章访问数: 7305
- HTML全文浏览量: 1238


 下载:
下载:












 下载:
下载:

