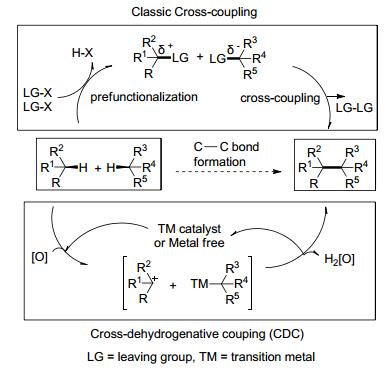
 图式 1
经典和交叉偶联反应构建C—C键的途径对照
Scheme1.
Comparison of classic cross-coupling and CDC
图式 1
经典和交叉偶联反应构建C—C键的途径对照
Scheme1.
Comparison of classic cross-coupling and CDC

Citation: Hu Wei, Long Yaqiu. Cross-Dehydrogenative Coupling Reactions Applied in the Construction of Privileged Heterocycles[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2850-2858. doi: 10.6023/cjoc201703033

应用于构建优势杂环骨架的交叉脱氢偶联反应
English
Cross-Dehydrogenative Coupling Reactions Applied in the Construction of Privileged Heterocycles
-
碳-碳键的形成是有机合成的主要内容, 其方法学研究一直是有机化学领域的热点.构建C—C键有多种方法, 传统的方法有亲核加成、取代、傅克反应等; 现代有机化学的发展催生了周环反应和过渡金属催化的交叉偶联反应, 大大提高了有机合成的效率和反应的适用性.但这些方法存在一些局限性, 例如需要特定的官能团活化、金属的参与、环境污染等.近年来, 通过特定催化剂可以实现C—H键和C—H键的直接偶联[1, 2], 称之为交叉脱氢偶联反应(Cross-dehydrogenative-cou-pling, 简称CDC反应[2a]), 其常用的催化剂有钯、铜、铁等金属盐, 以及一些非金属催化剂如过氧化氢、二氯二氰基苯醌(DDQ)、臭氧等(Scheme 1)[2a].首个报道的CDC反应是1993年由Miura课题组发展的二甲基苯胺和炔烃的偶联反应, 随后李朝军课题组[3]和其他课题组[4]通过大量的研究丰富了这一领域.
杂环化合物是分子中含有杂环结构的有机化合物, 构成环的原子除碳原子外还至少含有一个杂原子.杂芳香环骨架存在于许多天然产物和药物分子结构中, 如吲哚[5]、喹唑啉[6]、喹诺酮[7]、吡咯[8]、吡唑[9]、异噁唑等, 是生物活性的主要载体, 其合成一直是有机反应研究的热点[10].这些杂芳香环的合成方法发展得比较成熟, 包括多个人名反应.相对于这些传统方法, 采用CDC策略来构建杂环骨架显示出独特的优势, 例如原子经济性强、绿色环保、高反应选择性等[11].我们课题组应用
C—H氧化活化/官能团化这一策略, 从简单易得的底物出发, 发展了喹诺酮[7]、苯并咪唑[12]、喹唑啉[6]等一系列杂环骨架[13]的合成新方法, 并应用于新结构新机理的先导化合物的发现, 提高了活性化合物的发现效率[10b,14].
本文将对应用交叉脱氢偶联反应这一新策略构建类药性骨架的合成方法进行概括和讨论, 主要根据合成杂环骨架的类型进行分类介绍, 综述该领域的最新研究进展.
1 应用于吲哚的合成及衍生化
吲哚是天然产物和药物分子及活性中间体来源最丰富的骨架之一, 近100多年来吲哚的合成一直是有机化学研究的一个热点.最经典的反应是1883年建立的Fischer吲哚合成法, 以联氨或肼和酮为起始原料, 强酸条件下环化得到吲哚.但该方法存在一些缺陷, 比如联氨易致癌, 某些肼难以制备且不稳定, 强酸条件下某些官能团不耐受.因此, 简单、安全、高效的吲哚及其类似物的合成方法一直是科学家研究的方向[15].
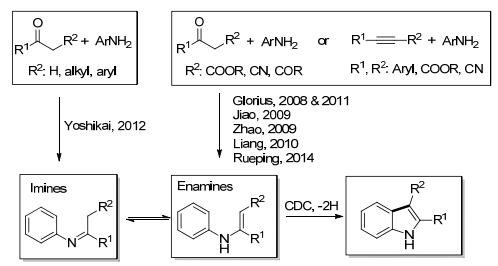
基于CDC策略的吲哚合成方法, 可以通过亚胺、烯胺替换联肼成功构建吲哚环(Scheme 2)[15a].亚胺与烯胺的互变异构中, 通常平衡倾向于亚胺, 但可以通过强吸电子取代基团稳定烯胺, 使平衡倾向于烯胺. 2008年, Glorius课题组[16]以稳定的N-芳基烯胺为原料, 开发了二价钯催化的C—H氧化环化反应.烯胺中的取代基(R2)必须为吸电子基以稳定烯胺结构, 反应以铜盐作氧化剂.焦宁课题组[17]随后作出改进, 并优化出一锅法制备吲哚的方法, 芳香胺和带有缺电子取代基的炔烃以二价钯作为催化剂在氧气中反应可以得到芳基烯胺中间体.赵康课题组[18]开发出无金属催化的、由醋酸碘苯介导的N-芳基烯胺为原料的吲哚合成法.梁永民课题组[19]则发展了价廉实用的铁催化体系用于吲哚的合成, 但是烯胺中取代基(R2)必须为酯基. 2014年Rueping课题组[20]报道了醋酸钯与氧化还原催化剂在可见光照射下活化C—H键生成吲哚环的反应, 该方法可以避免使用过量的铜盐、银盐.但这些烯胺中间体方法都具有特殊底物结构的要求导致产物结构受限. Yoshikai课题组[21]在此领域做出了突破性贡献, 他们以苯胺和酮为起始原料形成共同的亚胺中间体来构建吲哚环.此方法不需要先合成烯胺, 而是在反应过程中产生亚胺中间体, 通过亚胺和烯胺的互变异构并发生CDC反应, 最终可以一锅法得到吲哚.该反应需要氧气、二价钯的催化以及季胺盐的辅助.以亚胺为中间体环化成吲哚的方法, 极大地拓展了底物的适应性, 而且此方法可以放大量合成, 用于工业生产, 这也是CDC诱导的缩合串联反应.
CDC反应还可应用于吲哚环的衍生化[15]. 2005年, 李朝军课题组[3a]报道了吲哚C-3位的衍生化反应, 四氢异喹啉叔胺邻位的C—H键可被一价铜活化并与吲哚环在C(3)位发生C(sp3)—H和C(sp2)—H的偶联反应.当吲哚的C(3)位有取代基如甲基时, 吲哚的C(2)位被活化而参与偶联反应. CDC策略也可以应用于Diels-Alder反应(DA)生成吲哚衍生物(Eq. 1). 2015年张俊良课题组[4e]报道了应用CDC策略的DDQ促进的DA反应, 2-甲基-3-芳甲基吲哚和缺电子的烯烃发生DA反应产生四氢咔唑、咔唑及稠杂环的结构.该反应经过两次C(sp3)—H键的活化, 关环后进一步芳香化得到吲哚并环产物3.该方法为吲哚进一步衍生化、吲哚稠环的合成提供了新的合成路径.
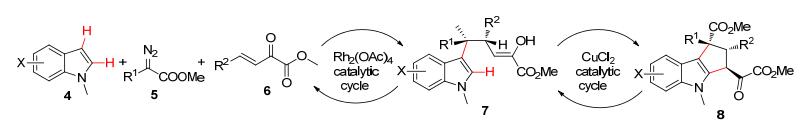
胡文浩课题组[22]报道了将二价铜催化的三组分的脱氢偶联反应用于环戊烷并吲哚的合成(Scheme 3).以简单取代的吲哚作为起始原料, 依次经过Rh-和Cu-催化的两次C—H官能团活化, 转换为具有光学活性的吲哚稠环衍生物8.
2 应用于吡咯及其衍生物的合成
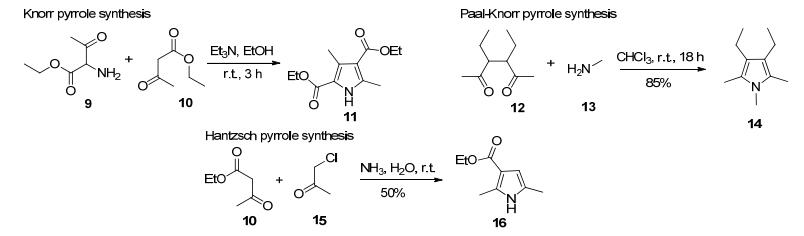
吡咯骨架广泛存在于天然产物、医药中间体和分子材料中.科学家一直在寻找高效、简单的合成方法来获得这类简单但用途广泛的杂环.吡咯的经典合成方法主要有三种(Scheme 4).其中Knorr吡咯合成法是以α-氨基酮和酮为原料, 乙醇为溶剂, 在室温下缩合环化得到吡咯11.这类反应选择性好, 反应产率也较高. Paal-Knorr吡咯合成法适合于多取代吡咯的合成, 二酮和胺可直接缩合得到吡咯环14. Hantzsch吡咯合成方法也采用类似的反合成切断策略, 通过α-卤代酮和烯胺的缩合合成吡咯16, 烯胺可以来自adole缩合. Hantzsch法合成吡咯的产率不是很高, 但是一级胺的使用极大地拓展了底物的适用性.
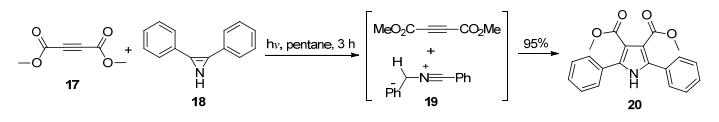
近年来, 很多合成吡咯的新方法被报道.例如周环反应、1, 3-偶极子与炔烃的加成反应, 后者经由一个[3+2]的环化反应(Scheme 5).虽然这类反应产率高, 几乎定量转化, 但由于反应需要光照, 且需特定的官能团稳定反应底物, 所以在吡咯的合成方法中不是很实用, 其意义在于机理上的新颖性.
李兴伟课题组[8]报道了烯胺酯和丙酮在银盐催化下发生CDC反应生成多取代的吡咯22的反应.但是, CDC反应中常用的氧化剂如氯化铁、DDQ、硝酸铈铵(CAN)和醋酸碘苯的使用都将导致该反应产率急剧下降.这是一个分子间的CDC反应, 且只发生在比较少见的酮类如丙酮中.调控丙酮的量, 可以得到另一种优势骨架吲哚(Eq. 2).
3 应用于吡唑及类似物的合成
吡唑是一类非常重要的杂环, 有比较广泛的生物学活性, 例如抗菌[23]、减肥[24]、抗肿瘤、抗白血病、抗炎、镇痛等.吡唑也可以作为很多药物和天然产物的合成中间体.虽然之前已经有很多种合成方法[25]被报道, 如联氨和1, 3-二羰基化合物的缩合, 重氮烷烃和烯烃/炔烃的1, 3-偶极子加成等, 但是, 原料易得、原子经济性高和环境友好的合成方法仍然广泛和迫切需要.
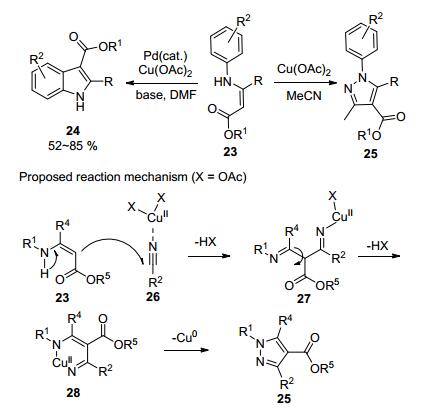
Glorius课题组[26]报道了烯胺酯和乙腈发生的CDC反应, 该反应经历了氧化性C—C键/N—N键形成的串联过程, 最终得到吡唑产物26 (Scheme 6).反应需要醋酸铜作催化剂和氧化剂, 乙腈既作为溶剂同时又参与反应.这是其课题组在此前研究脱氢偶联构建吲哚环的反应时偶然发现的, 由筛选溶剂时发现的副反应优化而来.
反应的机理是以二价铜作为路易斯酸引发反应, 醋酸铜同时起到氧化剂作用.乙腈首先和烯胺酮发生亲核加成, 离去一分子醋酸, 得到二亚胺中间体27. C—C单键旋转至最优构象促使继续脱去一分子醋酸, 得到二价铜螯合的六元环状中间体28, 之后经过还原消除, 得到吡唑产物25.该反应底物适用性非常好, 可从简单的原料如胺、酮、腈类等出发, 一锅法生成目标杂环化合物.
2013年葛海波课题组[27a]报道了铜催化的分子内脱氢偶联反应, 以N, N-二取代腙为底物, 1, 2-二氯乙烷(DCE)为溶剂, 发生了氧化、环化和芳构化反应生成30.这是首次发现的分子内铜催化的C(sp3)—H和C(sp3)—H的脱氢偶联反应构建吡唑杂环.反应的原子经济性高, 对环境友好(Eq. 3).
Kumar课题组[9]随后报道了取代的苯乙酮腙与芳香醛发生CDC反应, 生成吡唑33的合成方法(Eq. 4), 这是首次报道的由单质硫引发的CDC反应, 反应需要在1, 4-二氧六环中加热到120 ℃, 通过C—H活化直接形成C(sp3)—C(sp2)键.
葛海波课题组[27b]还发展了分子内对映选择性的交叉脱氢环化反应, 以多取代的腙为底物, 铜盐为催化剂, 发生两次C(sp3)—H官能团化.这也是首次报道的有氧条件下铜催化的经过亚胺中间体的对映选择性环化反应, 得到多取代的吡唑衍生物36 (Eq. 5).
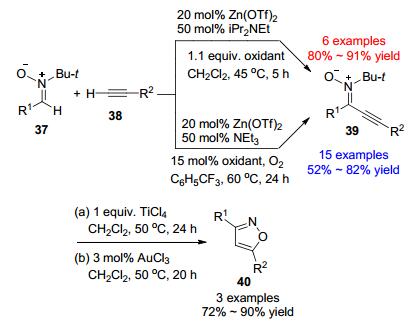
作为吡唑的生物电子等排体, 异噁唑骨架也可以经交叉脱氢偶联反应构建. Studer课题组[28]报道了硝酮37和炔烃38在锌盐催化下发生交叉脱氢偶联反应得到异噁唑40的反应(Scheme 7), 该反应所需的原料来源广泛.
4 应用于七元环、八元环的合成
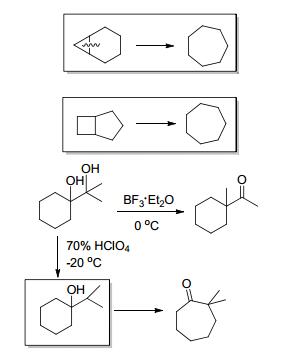
构建中等大小环系如七元环或八元环是非常有吸引力的, 这类环作为核心结构经常出现在不同的天然产物和药物活性分子中.由于中等环系不易发生跨环作用, 加之熵的不利因素, 所以七、八元环在合成上具有挑战性.目前也仅有少数几类合成七元环、八元环的方法.然而, 近年来出现的有机合成新技术和新理论, 为开发这些中等环的新合成方法提供了有力工具.
传统的七元环合成方法, 有通过环张力驱动的重排反应, 频哪醇重排及半频哪醇重排等方法推动的七元环合成(Scheme 8).
联烯是有机合成中非常有用的合成子, 过渡金属催化的联烯的环化反应经常被用于大环的合成, 麻生明等[29]在联烯领域有着非常深入的研究.近年来, 联烯也被用于CDC-促进的中等环系化合物的合成方法探索. Bckvall课题组[13]发现了一个以联烯为底物、经过多次C—H活化官能团化的反应, 产物42具有立体选择性(Eq. 6).
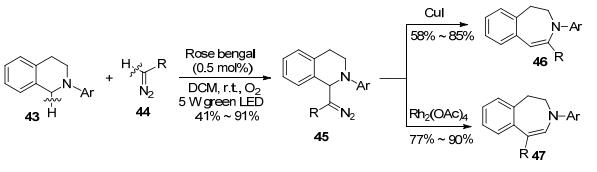
光催化也是近几年有机合成领域的一个热点, 周磊课题组[30]将光催化用于CDC反应的拓展研究中, 开发了无金属参与的在LED照射下发生的C(sp3)—H/ C(sp2)—H偶联反应, 随后扩环生成七元不饱和环的合成方法.四氢异喹啉43中的杂原子氮可以活化其邻位苄基位的C(sp3)—H键, 因而和重氮化合物44的C(sp2)—H键发生脱氢偶联反应, 得到的异喹啉衍生物45后续可以引发扩环反应产生不饱和七元杂环化合物46和47 (Scheme 9).
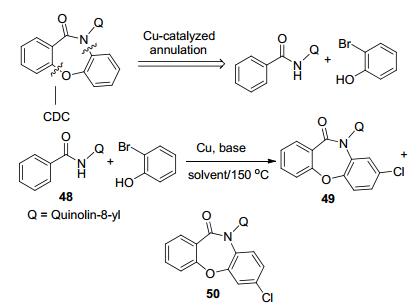
2016年马晨课题组[31]报道了铜催化的一锅法合成oxazepinone衍生物, 经过C(sp2)—H/O—H的脱氢偶联反应得到这一类七元稠杂环的衍生物49和50 (Scheme 10). Oxazepinone稠杂环的合成是药物化学研究的一个热点, 这类稠杂环具有多种生物活性, 如抗肿瘤、抗艾滋病(HIV)、抗菌等, 且其核心骨架发现有非典型的抗精神病抑制作用, 还可作为β分泌酶抑制剂或组蛋白去乙酰化酶抑制剂.
5 应用于其他芳香杂环的合成
2011年Pospech课题组[32]报道了金属Ru催化的交叉脱氢偶联反应得到邻羟甲基苯甲酸内酯52 (Eq. 7).
喹喔啉也是一类应用广泛的类药性骨架, 已经有多种合成方法被报道, 但大多需要复杂的底物及过渡金属催化.马晨课题组[33]在2015年报道了碘催化的一锅法合成吡咯并喹喔啉和咪唑并喹喔啉的反应, 反应经历了C(sp3)—H/C(sp2)—H的交叉脱氢偶联过程.其中, 二甲基亚砜(DMSO)作为氧化剂, 绿色环保.反应的产率高、底物适用性好, 是之前合成方法的一个补充(Eq. 8).
串联反应可以降低生产成本, 提高合成效率.近年来, 多组分的串联反应发展迅速, 已经报道了很多的CDC串联反应. 2013年包伟良课题组[34]报道了以苯胺55和多取代的内酰胺56为底物, 在铁催化下一锅法合成四氢喹啉衍生物57的反应.反应新形成了两个C—C键、一个C—N键, 同时断裂了一个C—N键; 内酰胺同时可以作为溶剂(Eq. 9).
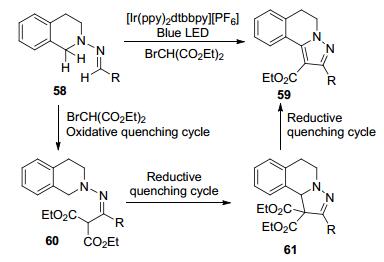
在多环体系的合成中, 接力催化(relay catalysis)促进的CDC串联反应是一个重要的手段[35].朱成建课题组[35c]报道了通过接力可见光氧化还原催化合成稠环吡唑61的CDC方法.从腙58出发, 在同一个光氧化还原催化剂作用下, 依次经历一个氧化性淬灭和两个还原性淬灭三个循环(Scheme 11), 实现了三个C—H键的直接官能团化, 高效构建了吡唑[5, 1-a]并异喹啉骨架.
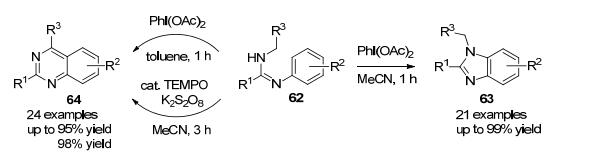
在运用CDC策略构建杂环的反应中, 溶剂的选择对反应的选择性有时起着非常重要的作用. 2014年, 我们课题组[6]第一次实现了通过溶剂极性或氧化剂体系调控C(sp3)—H/C(sp2)—H或N—H/C(sp2)—H的直接偶联, 从而选择性合成喹唑啉64和苯并咪唑63 (Scheme 12).苯并咪唑和喹唑啉均是非常重要的杂环骨架, 其合成方法也非常多.由于医药工业的特殊要求, 这些药物优势骨架的绿色合成方法一直是药物化学家关注的焦点.
具体而言, 我们课题组应用C—H氧化活化/官能团化的机理, 从N-烷基-N'-苯基甲脒底物62出发, 开发了醋酸碘苯促进的直接脱氢环化反应构建喹唑啉和苯并咪唑的新合成方法[6].通过溶剂极性的选择, 该反应可以高化学区域选择性地实现C(sp3)—H键或N—H键与C(sp2)—H键之间的分子内交叉脱氢偶联, 从而方便高效地得到多取代喹唑啉或苯并咪唑衍生物.进一步的氧化体系优化, 提供了氧化剂调控的喹唑啉和苯并咪唑的发散型合成方法.以廉价的K2S2O8作氧化剂, 催化量的2, 2, 6, 6-四甲基哌啶氧化物(TEMPO)存在下, N-烷基-N'-苯基甲脒在极性溶剂中快速高产率地转换成多取代喹唑啉衍生物, 从而为非极性溶剂中醋酸碘苯介导的喹唑啉合成方法提供了互补.共同底物N-烷基-N'-苯基甲脒62可由价廉易得的羧酸、苯胺和脂肪胺/苄胺通过两种偶联反应途径合成得到, 保证了宽泛底物结构类型的可获得性, 有利于结构多样性化合物库的构建.
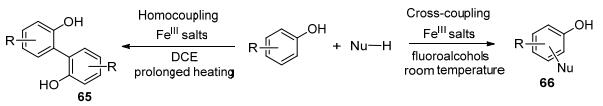
Pappo课题组[36]在2015年也报道了通过溶剂六氟异丙醇或DCE选择性调控苯酚氧化偶联的反应(Scheme 13).
在铁作为催化剂、DCE为溶剂的条件下, 苯酚可以自身进行脱氢偶联反应; 但是当使用氟醇类作为溶剂时, 室温条件下可以与亲核试剂发生脱氢偶联反应得到产物66.例如, 苯酚与环戊酮酸酯67的氧化偶联反应可以得到有光学活性的苯并呋喃环68 (Eq. 10).
作者之后又将此反应成功地用于天然产物的合成. Calodenin B与2, 3-dihydrocalodenin B是具有多种活性的双黄酮类化合物, 例如有抗真菌活性、对MCF-7乳腺癌细胞有强烈的细胞毒作用.作者从简单的苯酚类化合物69经过4步反应得到了这类黄酮天然产物[36](Eq. 11).
6 总结与展望
“绿色化学”是当前有机合成领域的热点研究方向, 而CDC反应正体现了这一需求和特点, 它具有传统合成方法不具备的多种优势:不需要预先官能团化的直接合成, 合成的高效性和原子经济性.最近几年, 应用CDC的策略合成类药性优势骨架, 如吲哚、吡咯、喹诺酮、喹唑啉、呋喃等是药物化学家关注的方向.通过新技术新方法的应用, C—C键、C—X (X为杂原子)键的新合成方法不断被拓展, 可以制备传统方法难以制备的特定取代的杂环结构, 特别是多环和手性取代杂环的合成可以选择性、高效性、便捷性地实现, 从而为新结构新机制先导化合物的发现提供了方法学保证和新结构来源.
-
-
[1]
(a) Wang, M. ; Wang, Z. ; Shang, M. ; Dai, H. Chin. J. Org. Chem. 2015, 35, 570 (in Chinese).
(王明明, 王子潇, 商明, 戴辉雄, 有机化学, 2015, 35, 570. )
(b) Lu, B. ; Li, X. ; Lin, Y. Chin. J. Org. Chem. 2015, 35, 2275 (in Chinese).
(卢贝丽, 李现艳, 林咏梅, 有机化学, 2015, 35, 2275. )
(c) Ding, Z. ; Tan, Q. ; Liu, B. ; Zhang, K. ; Xu, B. Acta Chim. Sinica 2015, 73, 1302 (in Chinese).
(丁正伟, 谭启涛, 刘秉新, 张可, 许斌, 化学学报, 2015, 73, 1302. )
(d) Yu, J. -Q. ; Ding, K. -L. Acta Chim. Sinica 2015, 73, 1223 (in Chinese).
(余金权, 丁奎岭, 化学学报, 2015, 73, 1223. ) -
[2]
(a) Girard, S. A.; Knauber, T.; Li, C.-J. Angew. Chem., Int. Ed. 2014, 53, 74.
(b) Li, G.; Nakamura, H. Angew. Chem., Int. Ed. 2016, 55, 6758. -
[3]
(a) Li, Z.; Li, C.-J. J. Am. Chem. Soc. 2005, 127, 6968.
(b) Li, Z.; Li, C.-J. J. Am. Chem. Soc. 2006, 128, 56.
(c) Zhang, Y.; Li, C.-J. J. Am. Chem. Soc 2006, 128, 4242. -
[4]
(a) Zhang, C.; Jiao, N. Angew. Chem., Int. Ed. 2010, 49, 6174.
(b) Han, W.; Mayer, P.; Ofial, A. R. Angew. Chem., Int. Ed. 2011, 50, 2178.
(c) Antonchick, A. P.; Burgmann, L. Angew. Chem., Int. Ed. 2013, 52, 3267.
(d) Meng, Z.; Sun, S.; Yuan, H.; Lou, H.; Liu, L. Angew. Chem., Int. Ed. 2014, 53, 543.
(e) Zhou, L.; Xu, B.; Zhang, J. Angew. Chem., Int. Ed. 2015, 54, 9092. -
[5]
Gensch, T.; Klauck, F. J. R.; Glorius, F. Angew. Chem., Int. Ed. 2016, 55, 11287. doi: 10.1002/anie.201605193
-
[6]
Lin, J.-P.; Zhang, F.-H.; Long, Y.-Q. Org. Lett. 2014, 16, 2822. doi: 10.1021/ol500864r
-
[7]
Hu, W.; Lin, J.-P.; Song, L.-R.; Long, Y.-Q. Org. Lett. 2015, 17, 1268. doi: 10.1021/acs.orglett.5b00248
-
[8]
Zhao, M.; Wang, F.; Li, X. Org. Lett. 2012, 14, 1412. doi: 10.1021/ol300147t
-
[9]
Vanjari, R.; Guntreddi, T.; Kumar, S.; Singh, K. N. Chem. Commun. 2015, 51, 366. doi: 10.1039/C4CC08210A
-
[10]
(a) Wang, L.; Woods, K. W.; Li, Q.; Barr, K. J.; McCroskey, R. W.; Hannick, S. M.; Gherke, L.; Credo, R. B.; Hui, Y.-H.; Marsh, K.; Warner, R.; Lee, J. Y.; Zielinski-Mozng, N.; Frost, D.; Rosenberg, S. H.; Sham, H. L. J. Med. Chem. 2002, 45, 1697.
(b) Zeng, L.-F.; Wang, Y.; Kazemi, R.; Xu, S.; Xu, Z.-L.; Sanchez, T. W.; Yang, L.-M.; Debnath, B.; Odde, S.; Xie, H.; Zheng, Y.-T.; Ding, J.; Neamati, N.; Long, Y.-Q. J. Med. Chem 2012, 55, 9492.
(c) Lam, T.; Hilgers, M. T.; Cunningham, M. L.; Kwan, B. P.; Nelson, K. J.; Brown-Driver, V.; Ong, V.; Trzoss, M.; Hough, G.; Shaw, K. J.; Finn, J. J. Med. Chem. 2014, 57, 651. -
[11]
Li, C.-J. Acc. Chem. Res. 2009, 42, 335. doi: 10.1021/ar800164n
-
[12]
Xue, D.; Long, Y.-Q. J. Org. Chem. 2014, 79, 4727. doi: 10.1021/jo5005179
-
[13]
Zhu, C.; Yang, B.; Qiu, Y.; Backvall, J. E. Angew. Chem., Int. Ed. 2016, 55, 14405. doi: 10.1002/anie.v55.46
-
[14]
(a) Cheng, Y.; Shen, J.; Peng, R.-Z.; Wang, G.-F.; Zuo, J.-P.; Long, Y.-Q. Bioorg. Med. Chem. Lett. 2016, 26, 2900.
(b) Zhi, Y.; Gao, L.-X.; Jin, Y.; Tang, C.-L.; Li, J.-Y.; Li, J.; Long, Y.-Q. Bioorg. Med. Chem. 2014, 22, 3670. -
[15]
(a) Shi, Z.; Glorius, F. Angew. Chem., Int. Ed. 2012, 51, 9220.
(b) Li, J.; Li, C.; Yang, S.; An, Y.; Wu, W.; Jiang, H. J. Org. Chem. 2016, 81, 7771.
(c) Gao, S.; Wu, Z.; Fang, X.; Lin, A.; Yao, H. Org. Lett. 2016, 18, 3906.
(d) Chen, J.; Wu, J. Angew. Chem., Int. Ed. 2017, 56, 3951.
(e) Li, J.; Li, C.; Yang, S.; An, Y.; Wu, W.; Jiang, H. J. Org. Chem. 2016, 81, 2875. -
[16]
Würtz, S.; Rakshit, S.; Neumann, J. J.; Dr ge, T.; Glorius, F. Angew. Chem., Int. Ed. 2008, 120, 7340. doi: 10.1002/ange.v120:38
-
[17]
Shi, Z.; Zhang, C.; Li, S.; Pan, D.; Ding, S.; Cui, Y.; Jiao, N. Angew. Chem., Int. Ed. 2009, 48, 4572. doi: 10.1002/anie.v48:25
-
[18]
Yu, W.; Du, Y.; Zhao, K. Org. Lett. 2009, 11, 2417. doi: 10.1021/ol900576a
-
[19]
Guan, Z.-H.; Yan, Z.-Y.; Ren, Z.-H.; Liu, X.-Y.; Liang, Y.-M. Chem. Commun. 2010, 46, 2823. doi: 10.1039/b923971e
-
[20]
Zoller, J.; Fabry, D. C.; Ronge, M. A.; Rueping, M. Angew. Chem., Int. Ed. 2014, 53, 13264. doi: 10.1002/anie.201405478
-
[21]
Wei, Y.; Deb, I.; Yoshikai, N. J. Am. Chem. Soc. 2012, 134, 9098. doi: 10.1021/ja3030824
-
[22]
Jiang, L.; Jin, W.; Hu, W. ACS Catal. 2016, 6, 6146. doi: 10.1021/acscatal.6b01946
-
[23]
Tanitame, A.; Oyamada, Y.; Ofuji, K.; Fujimoto, M.; Iwai, N.; Hiyama, Y.; Suzuki, K.; Ito, H.; Terauchi, H.; Kawasaki, M.; Nagai, K.; Wachi, M.; Yamagishi, J.-I. J. Med. Chem. 2004, 47, 3693. doi: 10.1021/jm030394f
-
[24]
Wu, C.-H.; Hung, M.-S.; Song, J.-S.; Yeh, T.-K.; Chou, M.-C.; Chu, C.-M.; Jan, J.-J.; Hsieh, M.-T.; Tseng, S.-L.; Chang, C.-P.; Hsieh, W.-P.; Lin, Y.; Yeh, Y.-N.; Chung, W.-L.; Kuo, C.-W.; Lin, C.-Y.; Shy, H.-S.; Chao, Y.-S.; Shia, K.-S. J. Med. Chem. 2009, 52, 4496. doi: 10.1021/jm900471u
-
[25]
Fustero, S.; Sánchez-Roselló, M.; Barrio, P.; Simón-Fuentes, A. Chem. Rev. 2011, 111, 6984. doi: 10.1021/cr2000459
-
[26]
Neumann, J. J.; Suri, M.; Glorius, F. Angew. Chem., Int. Ed. 2010, 49, 7790. doi: 10.1002/anie.v49:42
-
[27]
(a) Zhang, G.; Zhao, Y.; Ge, H. Angew. Chem., Int. Ed. 2013, 52, 2559.
(b) Wu, X.; Wang, M.; Zhang, G.; Zhao, Y.; Wang, J.; Ge, H. Chem. Sci. 2015, 6, 5882. -
[28]
Murarka, S.; Studer, A. Org. Lett. 2011, 13, 2746. doi: 10.1021/ol200849k
-
[29]
Ye, J. T.; Ma, S. M. Acc. Chem. Res. 2014, 47, 989. doi: 10.1021/ar4002069
-
[30]
Xiao, T.; Li, L.; Lin, G.; Mao, Z.-W.; Zhou, L. Org. Lett. 2014, 16, 4232. doi: 10.1021/ol501933h
-
[31]
Zhang, Z.; Dai, Z.; Ma, X.; Liu, Y.; Ma, X.; Li, W.; Ma, C. Org. Chem. Front. 2016, 3, 799. doi: 10.1039/C6QO00040A
-
[32]
Ackermann, L.; Pospech, J. Org. Lett. 2011, 13, 4153. doi: 10.1021/ol201563r
-
[33]
Zhang, Z.; Xie, C.; Tan, X.; Song, G.; Wen, L.; Gao, H.; Ma, C. Org. Chem. Front. 2015, 2, 942. doi: 10.1039/C5QO00124B
-
[34]
Sun, M.; Zhang, T.; Bao, W. J. Org. Chem. 2013, 78, 8155. doi: 10.1021/jo400979h
-
[35]
(a) Dhiman, S.; Mishra, U. K.; Ramasastry, S. S. V. Angew. Chem., Int. Ed. 2016, 55, 7737.
(b) Garkhedkar, A. M.; Senadi, G. C.; Wang, J. J. Org. Lett. 2017, 19, 488.
(c) Cheng, J.; Li, W. P.; Duan, Y. Q.; Cheng, Y. X.; Yu, S. Y.; Zhu, C. J. Org. Lett. 2017, 19, 214. -
[36]
Gaster, E.; Vainer, Y.; Regev, A.; Narute, S.; Sudheendran, K.; Werbeloff, A.; Shalit, H.; Pappo, D. Angew. Chem., Int. Ed. 2015, 54, 4198. doi: 10.1002/anie.201409694
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 2964
- HTML全文浏览量: 350


 下载:
下载:












 下载:
下载:

