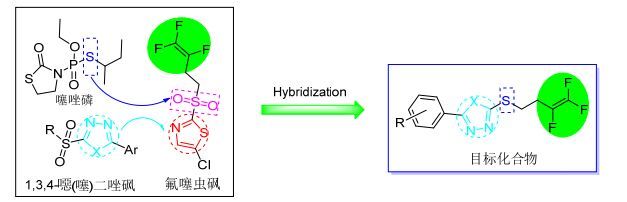
 图1
目标化合物的设计
Figure1.
Design of the title compounds
图1
目标化合物的设计
Figure1.
Design of the title compounds

Citation: Chen Xuewen, Gan Xiuhai, Chen Jixiang, Chen Yongzhong, Wang Yanjiao, Hu Deyu, Song Baoan. Synthesis and Nematicidal Activity of Novel 1, 3, 4-Oxadiazole (Thiadiazole) Thioether Derivatives Containing Trifluorobuten Moiety[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2343-2351. doi: 10.6023/cjoc201703022

新型含三氟丁烯的1, 3, 4-噁二唑(噻二唑)硫醚类衍生物的合成及杀线虫活性研究
-
关键词:
- 1, 3, 4-噁二唑(噻二唑)硫醚
- / 三氟丁烯
- / 杀线虫活性
- / 秀丽隐杆线虫
- / 柑橘线虫
English
Synthesis and Nematicidal Activity of Novel 1, 3, 4-Oxadiazole (Thiadiazole) Thioether Derivatives Containing Trifluorobuten Moiety
-
植物线虫是植物侵染性病原之一, 因其分布广泛、体积微小、隐于地下、重创植物根系的特性[1], 能导致主要农作物减产约12.3%, 严重时损失可达60%, 据不完全统计, 在全球范围内每年由植物线虫给农业造成的损失超过1000亿美元[2~4].根结线虫(Meloidogyne spp.)是一种对全球农作物造成严重危害的植物线虫之一, 可寄生于蔬菜、粮食作物及果树等多种寄主的根部, 吸取营养物质使寄主缺乏营养而减产.秀丽隐杆线虫(Caenorhabditis elegans)和柑橘线虫(Tylenchus semipenetrans)是两种典型的植物线虫.目前, 对线虫病的防治方法仍以化学防治为主, 人们用各种杀线虫药剂来防治线虫对农作物的危害[5].噻唑磷[6]是目前防治根结线虫较好的商品药剂, 但过量使用或施用方式不合理, 将导致植株生长缓慢, 根系发育不良, 叶片发黄等危害, 另外由于对哺乳动物的高毒性和对生态环境严重的负面效应而被限制使用[7].因此, 寻找一种高效、低毒、环境友好的杀线虫剂已成为植物保护领域一个亟待解决的问题.
三氟丁烯类化合物因其高药效、环境友好的特点, 被广泛应用于杀线虫剂研究方面[8, 9].氟噻虫砜是近20多年中开发的唯一一个三氟丁烯类杀线虫剂, 由马克西姆公司于2014年在美国取得登记, 它对多种植物线虫具有触杀活性, 与有机磷或氨基甲酸酯类的杀线虫剂相比, 具有高效、低毒、易降解等优点[10, 11]. 1, 3, 4-噁(噻)二唑类化合物因其具有良好的抗菌[12, 13]、杀虫[14, 15]及除草[16]等农用活性, 在植物病虫害的防控中得到了广泛的应用.本课题组前期对1, 3, 4-噁(噻)二唑及其衍生物的结构改造和生物活性方面做了深入的研究, 并合成了一系列具有较高活性的1, 3, 4-噁(噻)二唑硫醚(砜)类衍生物, 多数化合物表现出较好的抗菌[17, 18]及抗病毒活性[19].本文利用活性亚结构叠加及杂交原理, 以高活性杀线虫药剂氟噻虫砜为先导结构, 将1, 3, 4-噁(噻)二唑环代替噻唑环, 硫醚键取代砜键, 设计合成了一系列含三氟丁烯的1, 3, 4-噁(噻)二唑硫醚类衍生物(图 1), 并以秀丽线虫和柑橘线虫为研究对象, 通过室内直接触杀法, 对目标化合物杀线虫活性进行测定, 结果表明标题化合物表现出较好的杀线虫活性.目标化合物的合成路线如Scheme 1所示.
1 结果与讨论
1.1 目标化合物的合成
我们以目标化合物5a为研究对象, 在中间体硫醇、缚酸剂及4-溴-1, 1, 2-三氟丁烯摩尔比为1:1.2:1.1的前提下, 探究了不同溶剂、不同缚酸剂、不同反应温度和不同时间对5a收率的影响.由表 1可知, 在投料比为1:1.2:1.1的条件下, 以乙腈为溶剂, 碳酸钾为缚酸剂, 回流2.5 h是制备目标化合物较佳的合成条件, 化合物5a的收率为87%.该合成方法反应条件温和, 后处理较简便.以此方法合成了其它目标化合物, 通过合成发现苯环上具有吸电子基团的中间体硫醇与4-溴-1, 1, 2-三氟-1-丁烯反应速度较慢, 但产率高.
 表 1
不同反应条件对目标化合物5a合成收率的影响
Table 1.
Effects of reaction conditions on the synthesis of the target compound 5a
表 1
不同反应条件对目标化合物5a合成收率的影响
Table 1.
Effects of reaction conditions on the synthesis of the target compound 5a
Entry Solvent Acid-accepter Reaction temperature Reaction time/h Yield/% 1 DMF KOH Room temperature 39 86 2 Acetone KOH Room temperature 25 88 3 CH3CN KOH Room temperature 22 86 4 Acetone NaOH Reflux 2.5 84 5 CH3CN NaOH Reflux 2.0 87 6 CH3CN K2CO3 Reflux 2.5 87 7 Acetone K2CO3 Reflux 2.5 87 1.2 图谱分析
所合成的目标化合物均通过IR、1H NMR、13C NMR、ESI-MS及元素分析确定结构.我们以化合物5a为例进行解析, 从目标化合物的红外光谱可以看出, 1800 cm-1有特征吸收峰, 是由噁二唑和噻二唑环上C=N—N=C伸缩振动引起的; 苯环的骨架振动在1589~1450 cm-1处出现多条谱带形成特征吸收峰组; 噁二唑环和噻二唑环上C—O—C和C—S—C伸缩振动位于1175和1080 cm-1附近, 强度中等; 在1432~1303 cm-1附近有特征吸收峰, 是由三氟丁烯的C=C伸缩振动引起的; 在1032 cm-1出现的谱带为C—F的吸收峰.在核磁共振氢谱中, δ 7.95~7.60之间的多重峰是苯环上的氢的吸收信号; 在高场δ2.96处出现的峰为三氟丁烯3位氢的吸收信号, 其二重峰由于氟原子的影响被裂分成dtdd峰.在目标化合物核磁共振碳谱中, 化学位移δ 164.6和163.2处的吸收峰为噁二唑环中的两个碳原子, 这是由于与之直接相邻的N和O双重诱导效应导致的; δ 137.7~121.6为苯环上碳原子和丁烯双键碳原子的吸收峰, 其中, δ 156.2, 153.6, 151.4的三重峰和δ 127.2, 126.6的双峰分别为三氟丁烯结构中的1、2位碳原子, 因分别连接2个和1个氟原子, 因此其碳谱吸收峰分别裂分为三重峰和双峰, 这与原料4-溴-1, 1, 2-三氟-1-丁烯碳谱中δ 156.3, 154.0, 151.9的三重峰和δ 127.6, 125.7的双峰相吻合.另外δ 28.7和16.2处的吸收峰分别为三氟丁烯结构中的4、3位碳原子的吸收峰. ESI-MS m/z 287 [M+H]+.综上所述, 化合物5a的结构参数与其化学结构一致.
1.3 化合物对秀丽线虫的毒杀活性
以噻唑磷和氟噻虫砜为对照药剂, 初始浓度为200µg/mL下, 用直接触杀法测定了所合成18个2-(取代苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)硫]-13, 4-噁(噻)二唑类化合物对秀丽线虫毒杀活性, 测试结果见表 2.活性分级标准如下: A级, 高活性, 校正死亡率>80%; B级, 中等活性, 50%<校正死亡率<80%; C级, 弱活性, 校正死亡率<50%;每个处理重复三次得平均校正死亡率.
 表 2
目标化合物对秀丽线虫的离体活性(200 µg/mL)
Table 2.
Nematicidal activity of title compounds against C. elegans in vitro (200 µg/mL)
表 2
目标化合物对秀丽线虫的离体活性(200 µg/mL)
Table 2.
Nematicidal activity of title compounds against C. elegans in vitro (200 µg/mL)
Compd. 校正死亡率/% 24 h 48 h 72 h 5a 66.4±0.4 91.5±0.8 95.4±4.1 5b 61.1±2.4 58.9±2.4 76.2±2.7 5c 27.4±1.3 58.0±4.3 54.4±1.5 5d 37.9±6.2 75.0±3.2 95.5±2.2 5e 51.7±4.6 76.9±1.1 95.8±2.1 5f 61.3±0.5 74.8±5.4 100.0±0.0 5g 58.2±1.6 79.6±0.9 98.4±1.3 5h 58.7±3.9 85.1±0.1 87.4±2.2 5i 67.3±1.1 94.0±2.6 97.7±2.0 6a 1.8±3.1 88.4±1.0 100.0±0.0 6b 47.9±5.0 91.8±3.6 100.0±0.0 6c 17.7±3.5 75.1±3.6 94.6±1.6 6d 37.2±3.0 88.4±6.5 100.0±0.0 6e 22.5±4.6 26.8±2.1 88.3±19.4 6f 33.6±4.4 94.6±1.5 100.0±0.0 6g 29.9±6.7 67.8±2.6 100.0±2.5 6h 59.1±1.9 64.1±2.2 73.0±6.6 6i 8.6±3.4 7.3±0.8 68.4±2.6 噻唑磷 39.3±2.3 59.9±3.1 87.5±2.2 氟噻虫砜 37.3±4.7 60.4±3.9 86.4±2.7 由表 2可知, 在浓度为200 µg/mL时, 施药24 h后, 化合物5a、5b、5e、5f、5g、5h、5i和6h对秀丽线虫表现出中等毒杀活性, 其对秀丽线虫的校正死亡率分别为66.4%、61.1%、51.7%、61.3%、58.2%、58.7%、67.3%和59.1%, 优于对照药剂噻唑磷(39.3%)和氟噻虫砜(37.3%).施药48 h后, 多数化合物对秀丽线虫表现出较好的毒杀活性, 其中化合物5a、5h、5i、6a、6b、6d及6f对秀丽线虫表现出较高的毒杀活性, 其对秀丽线虫的校正死亡率分别为91.5%、85.1%、94.0%、88.4%、91.8%、88.4%及94.6%, 明显优于对照药剂噻唑磷(59.9%)和氟噻虫砜(60.4%).施药72h后, 大部分化合物对秀丽线虫的校正死亡率>80%, 表现出较好的活性, 其中化合物5f、6a、6b、6d、6f及6g对秀丽线虫均表现出100%的毒杀活性, 明显优于对照药剂噻唑磷(87.5%)和氟噻虫砜(86.4%).初步构效关系分析可知, 施药24 h后, 1, 3, 4-噁二唑硫醚类化合物对秀丽线虫的毒杀活性.
为了进一步确认目标化合物对秀丽线虫的毒杀活性, 采用直接触杀法测定了部分化合物在不同浓度下于试药24和48 h后对秀丽线虫的致死率, 每处理重复三次.将致死率转换成机率值(y)、药剂浓度(µg/mL)转换成对数值(x), 进行回归分析, 得到毒力回归方程(y=ax+b)和相关系数(r), 计算药剂对秀丽线虫的半数致死浓度(LC50), 结果见表 3.
Compd. 24 h 48 h y=ax+b LC50/(µg•mL-1) r y=ax+b LC50/(µg•mL-1) r 5a 0.2561x+4.4233 178.59±1.44 0.4760 0.5889x+4.2104 21.92±2.09 0.7176 5b 1.0746x+2.4188 252.35±0.03 0.9174 1.3985x+2.4206 69.89±1.01 0.9904 5d 0.8283x+3.0091 253.28±0.73 0.9347 1.1520x+2.9093 74.94±3.40 0.9430 5e 1.2753x+2.2218 150.82±0.03 0.9077 1.3583x+2.5460 64.07±5.97 0.9155 5f 1.1755x+1.9598 385.75±0.61 0.8958 1.3051x+2.5362 77.24±0.12 0.9567 5g 1.3294x+2.0799 157.24±0.27 0.9834 1.3294x+2.0799 157.24±0.27 0.9834 5h 1.2534x+1.9359 278.38±0.12 0.9712 1.2528x+2.2710 150.77±0.31 0.9275 6a 1.0749x+2.1040 494.54±2.15 0.8546 1.4246x+2.0135 124.85±6.78 0.9365 6b 1.2812x+2.1805 158.73±0.07 0.9473 0.8287x+3.6305 44.94±9.07 0.9136 6c 1.8643x+0.5573 241.57±1.61 0.9243 1.6076x+1.7553 104.62±3.75 0.9849 6d 3.0666x−1.7362 157.27±0.91 0.9732 2.4063x+0.2403 95.06±1.16 0.9483 6f 2.5168x−0.6585 177.13±1.04 0.8863 2.3477x+0.1335 118.27±5.65 0.9656 6g 1.6108x+1.5416 140.28±0.09 0.9396 1.3250x+2.5826 66.75±4.86 0.8893 噻唑磷 1.5526x+1.8895 100.78±1.27 0.9878 1.0929x+2.9667 72.52±3.15 0.9675 氟噻虫砜 1.2150x+2.4961 115.03±1.27 0.8989 0.9481x+3.2334 86.44±3.85 0.9972 由表 3可知, 所测化合物在给药24 h后的LC50均高于阳性对照药剂噻唑磷和氟噻虫砜, 但在给药48 h后, 部分化合物表现出较小的LC50值, 其中化合物5a和6b的LC50分别为21.92和44.94 μg/mL, 均明显优于对照药剂噻唑磷(72.52 μg/mL)和氟噻虫砜(86.44 μg/mL).结果表明所测化合物在施药后期对秀丽线虫表现出较好的毒杀活性.
1.4 部分目标化合物对柑橘线虫的毒杀活性
为了探明所合成化合物杀虫活性的广谱性, 以噻唑磷和氟噻虫砜为对照药剂, 于100 µg/mL的浓度下, 用直接触杀法测定了部分目标化合物在给药48和72 h后对柑橘线虫的毒杀活性, 结果见表 4.分级标准同化合物对秀丽线虫毒杀活性分级标准.
 表 4
部分化合物对柑橘的毒杀活性(100 µg/mL)
Table 4.
Nematicidal activity of some compounds against T. semipenetrans in vitro (100 µg/mL)
表 4
部分化合物对柑橘的毒杀活性(100 µg/mL)
Table 4.
Nematicidal activity of some compounds against T. semipenetrans in vitro (100 µg/mL)
Compd. 校正死亡率/% 48 h 72 h 5b 79.9±2.2 96.7±2.5 5c 65.5±6.5 81.8±2.6 5d 74.5±5.4 87.3±4.4 5e 68.1±6.1 79.8±2.9 5f 67.3±4.1 78.7±6.0 6b 78.5±5.2 85.9±8.3 6d 75.9±7.8 80.3±5.5 6f 42.7±4.6 79.8±6.0 噻唑磷 67.9±4.4 84.5±1.7 氟噻虫砜 58.7±0.1 76.9±0.2 由表 4可知, 在100 μg/mL时, 给药48h后化合物5b、5d、5e、6b和6d对柑橘线虫表现出中等毒杀活性, 其对柑橘线虫的校正死亡率分别为79.9%、74.5%、68.1%、78.5%和75.9%, 优于对照药剂噻唑磷(67.9%)和氟噻虫砜(58.7%).给药72 h后, 化合物5b、5d和6b对柑橘线虫表现出较好毒杀活性, 其对柑橘线虫的校正死亡率分别为96.7%、87.3%和85.9%, 均优于对照药剂噻唑磷(84.5%)和氟噻虫砜(76.9%).
初步的构效关系分析发现, 在施药24 h后, 1, 3, 4-噁二唑硫醚类化合物对秀丽线虫的毒杀活性要略高于相应的1, 3, 4-噻二唑硫醚类化合物的活性, 如5a>6a, 5b>6b, 5f>6f等; 但随着施药时间的延长, 1, 3, 4-噁二唑硫醚类化合物和1, 3, 4-噻二唑硫醚类化合物对秀丽线虫的毒杀活性的差距减小, 在施药达72 h时, 部分1, 3, 4-噻二唑硫醚类化合物对秀丽线虫的毒杀活性要略高于相应的1, 3, 4-噁二唑硫醚类化合物, 如6a>5a, 6b>5b, 6d>5d和6g>5g.另外, 芳环上取代基的种类和位置对化合物的杀线虫活性具有明显的影响.对于1, 3, 4-噁二唑硫醚类化合物来说, 在苯环的2位引入供电子基团(OH)时化合物的杀线活性较好, 例如:化合物5i施药24 h后对秀丽线虫的校正死亡率为67.3%;施药24和48 h后, 在苯环的4位引入基团不利于杀线活性, 其中吸电子基团更不利于活性, 例如5a>5g>5b.对于1, 3, 4-噻二唑类化合物来说, 施药24 h后, 在苯环的2位引入供电子基团(OCH3)时化合物的杀线活性较好, 例如化合物6h施药24 h后对秀丽线虫的校正死亡率为59.1%.施药24 h后, 在苯环的4位引入弱吸电子基团时化合物具有一定的杀线活性, 例如化合物6b施药24h后对秀丽线虫的校正死亡率为47.9%.施药48 h内, 在苯环的4位引入吸电子基团有利于杀线虫活性, 例如6b>6a>5g; 施药72 h后, 引入供电子基团不利于杀线活性, 例如6h和6a对秀丽线虫的毒杀活性均弱于其它化合物的活性.
2 结论
本文利用活性亚结构组合原理, 设计并合成了18个新型的含三氟丁烯的1, 3, 4-噁二唑(噻二唑)硫醚衍生物.杀线虫活性结果表明, 化合物5a和6b在施药后期对秀丽线虫表现出较好毒杀活性, 在施药48 h后对秀丽线虫毒杀活性的LC50分别为21.92和44.94 μg/mL, 明显优于阳性对照药剂噻唑膦(72.52 μg/mL)和氟噻虫砜(72.96 μg/mL).另外, 在浓度为100 µg/mL下, 施药48和72 h后, 大多数化合物对柑橘线虫表现出较好的毒杀活性, 其中化合物5b对柑橘线虫的毒杀活性分别为79.9%和96.7%, 优于对照药剂噻唑磷(67.9%和84.5%)和氟噻虫砜(58.7%和76.9%).结果表明含三氟丁烯的1, 3, 4-噁二唑(噻二唑)硫醚衍生物在杀线虫剂的开发与应用中具有一定的潜在价值.
3 实验部分
3.1 仪器与试剂
IR数据由Bruker VECTOR 22型红外光谱测定仪(KBr压片)测定; 1H NMR和13C NMR数据由JEOLECX-500 MHz超导核磁共振波谱仪(TMS为内标, DMSO-d6为溶剂)测定; 元素分析数据由德国Elememtar Vario-Ⅲ型元素分析仪测定; 熔点由X-4型数字显示显微熔点测定仪(温度计未校正)测定; 药品称量在Sarforius型电子天平(精度: 1/10000 g)上完成; MS由Agilent 5973 (Agilent, Santa Clara, CA, USA)测定. SW-CJ-1D超净工作台(苏州净化); LDZX-50KB高压灭菌锅(上海中安医疗器械厂); GSP-9160MBE隔水式恒温培养箱(上海博迅实业有限公司医疗设备厂); QL-90涡旋振荡仪(海门市莫林贝尔仪器); BX41体式显微镜(奥林巴斯); BSA124S分析天平(赛多利斯科学仪器); KYC-100C恒温培养摇床(上海沪粤明科学仪器有限公司); TGL-16C离心机(上海安亭科学仪器).野生型秀丽线虫(C. eleganN2) 和大肠杆菌OP50由云南大学张克勤教授惠赠; 柑橘线虫(T. semipenetrans)土壤样品从广西桂林柑橘研究所柑橘果园、广西良丰农场、广西特色农作物研究所采集.胆固醇(AR, BBI生命科学有限公司); 琼脂糖(北京Solarbio科技有限公司); 胰蛋白胨(OXOID); 酵母粉(OXOID); 次氯酸钠(AR, 天津市科密欧化学试剂). 4-溴-1, 1, 2-三氟-1-丁烯(BTFB)从北京百灵威化学试剂有限公司购买, 其它试剂和溶剂如无特别说明, 均为化学纯或分析纯.
3.2 实验方法
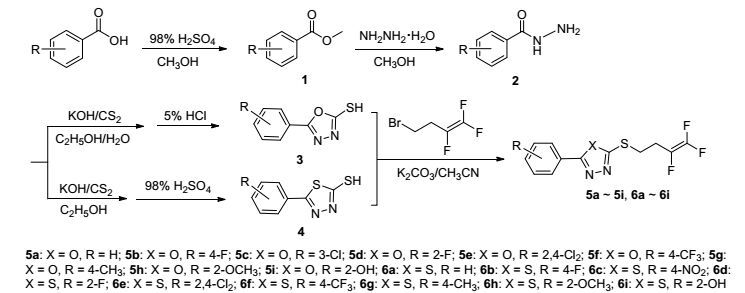
中间体3和4参照文献[20]方法, 以取代苯甲酸为原料通过酯化、肼解、成盐、闭环制备.
3.2.1 目标化合物5a~5i和6a~6i的合成
在50 mL三口瓶中加入中间体3或4 (2.81 mmol), 碳酸钾(3.37 mmol)和15 mL乙腈, 在室温下搅拌30 min, 然后将含0.58 g 4-溴-1, 1, 2-三氟-1-丁烯的5 mL乙腈溶液滴加到上述体系中.然后升温回流1~3 h, 薄层色谱(TLC) [V(石油醚)/V(乙酸乙酯)=3/1]跟踪反应进程.反应结束后, 冷却至室温, 过滤除去不溶性盐, 减压蒸去溶剂, 残渣用饱和食盐水洗涤, 过滤, 二氯甲烷重结晶得到目标化合物5a~5i和6a~6i.
2-苯基-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5a):白色固体, 收率81%. m.p. 57~58 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.99 (d, J=8.5 Hz, 2H, ArH), 7.92 (d, J=2.1 Hz, 2H, ArH), 7.68~7.65 (m, 1H, ArH), 3.54 (t, J=6.9 Hz, 2H, SCH2), 2.96 (dtdd, J=23.0, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 164.6, 163.2, 156.2 (153.7, 151.4), 137.7, 133.2, 132.8, 131.3, 128.7, 127.2 (126.6), 121.6, 28.7, 26.3 (26.1); IR (KBr) ν: 1800, 1589, 1558, 1450, 1432, 1413, 1379, 1304, 1234, 1201, 1176, 1080, 1033 cm-1; ESI-MS m/z: 287.40 [M+H]+. Anal. calcd for C12H9F3N2OS: C 50.35, H 3.17, N 9.79; found C 50.33, H 3.18, N 9.66.
2-(4-氟苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5b):白色固体, 收率84%. m.p. 42~43 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.05~8.02 (m, 2H, ArH), 7.48~7.43 (m, 2H, ArH), 3.53 (t, J=6.8 Hz, 2H, SCH2), 2.93 (dtdd, J=23.0, 6.8, 3.9, 2.7 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6)δ: 165.6, 165.0, 163.7, 155.9 (154.0, 151.8), 129.7, 129.6, 128.9 (127.1), 120.2, 117.3, 117.1, 28.7, 26.3 (26.1); IR (KBr) ν: 1800, 1612, 1602, 1506, 1445, 1440, 1306, 1204, 1200, 1115, 1200, 1176, 1151, 1100 cm-1; ESI-MS m/z: 305.26 [M+H]+, 327.26 [M+Na]+. Anal. calcd for C12H8F4N2OS: C 47.37, H 2.65, N 9.21; found C 47.43, H 2.74, N 9.59.
2-(3-氯苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5c):白色固体, 收率87%. m.p. 45~46 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.92 (t, J=1.8 Hz, 1H, ArH), 7.67~7.66 (m, 1H, ArH), 7.67 (ddd, J=8.1, 2.0, 1.0 Hz, 1H, ArH), 7.59 (t, J=7.9 Hz, 1H, ArH), 3.50 (t, J=6.8 Hz, 2H, SCH2), 2.88 (dtdd, J=23.1, 6.8, 4.1, 2.7 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6)δ: 164.6, 164.3, 155.9 (154.1, 151.8), 134.6, 132.4, 132.0, 129.1 (128.7), 127.1, 126.4, 125.6, 125.4, 28.7, 26.3 (26.1); IR (KBr) ν: 1796, 1555, 1462, 1433, 1408, 1296, 1241, 1193, 1181, 1095, 1064, 1064 cm-1; ESI-MS m/z: 321.10 [M+H]+, 343.01 [M+Na]+, 359.30 [M+K]+. Anal. calcd for C12H8ClF3N2OS: C 44.94, H 2.51, N 8.73; found C 44.66, H 2.50, N 8.59.
2-(2-氟苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5d):白色固体, 收率79%. m.p. 46~47 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.03~8.01 (m, 1H, ArH), 7.71~7.69 (m, 1H, ArH), 7.50 (ddd, J=11.1, 8.4, 0.8 Hz, 1H, ArH), 7.47~7.42 (m, 1H, ArH), 3.53 (t, J=6.8 Hz, 2H, SCH2), 2.95 (dtdd, J=23.0, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6)δ: 164.1, 162.4, 160.6, 158.5, 155.9 (154.0, 151.4), 134.8, 129.9, 128.9 (126.8), 125.9, 117.7, 111.8, 28.7, 26.2 (26.1); IR (KBr) ν: 1800, 1620, 1587, 1548 1538, 1434, 1374, 1346, 1300, 1258, 1248, 1116, 1113, 1074, 1030 cm-1; ESI-MS m/z: 305.41 [M+H]+, 327.40 [M+Na]+. Anal. calcd for C12H8F4N2OS: C 47.37, H 2.65, N 9.21; found C 47.37, H 2.80, N 9.58.
2-(2, 4-二氯苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5e):白色固体, 收率85%. m.p. 34~35 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.99 (d, J=8.5 Hz, 1H, ArH), 7.92 (d, J=2.1 Hz, 1H, ArH), 7.68~7.66 (m, 1H, ArH), 3.54 (t, J=6.9 Hz, 2H, SCH2), 2.92 (dtdd, J=23.0, 6.8, 4.0, 2.7 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 164.6, 163.2, 155.9 (153.7, 151.8), 137.7, 133.2, 132.8, 131.3, 128.7, 127.1 (126.8), 121.7, 28.7, 26.2 (26.1); IR (KBr) ν: 1801, 1589, 1559, 1469, 1432, 1379, 1304, 1234, 1201, 1177, 1161, 1087, 1033 cm-1; ESI-MS m/z: 356.40 [M+H]+, 378.01 [M+Na]+. Anal. calcd for C12H7Cl2F3N2OS: C 40.58, H 1.99, N 7.89; found C 40.78, H 2.06, N 8.22.
2-(4-三氟甲基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5f):白色固体, 收率83%. m.p. 46~48 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.19 (d, J=8.0 Hz, 2H, ArH), 7.97 (d, J=8.5 Hz, 2H, ArH), 3.56 (t, J=6.8 Hz, 2H, SCH2), 2.93 (dtdd, J=23.0, 6.8, 4.0, 2.7 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 164.7, 156.2 (153.7, 151.4), 132.2, 131.9, 129.1 (128.6), 127.8, 127.3, 126.9, 125.3, 123.1, 28.7, 26.2 (26.1); IR (KBr) ν: 1798, 1623, 1562, 1471, 1437, 1417, 1330, 1298, 1237, 1187, 1161, 1130, 1094 cm-1; ESI-MS m/z: 355.02 [M+H]+, 377.03 [M+Na]+, 393.11 [M+K]+. Anal. calcd for C13H8F6N2OS: C 44.07, H 2.28, N 7.91; found C 43.96, H 2.46, N 8.11.
2-(4-甲基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5g):白色固体, 收率80%. m.p. 49~50 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.82 (d, J=8.0 Hz, 2H, ArH), 7.37 (t, J=7.9 Hz, 2H, ArH), 3.47 (t, J=6.8 Hz, 2H, SCH2), 2.86 (dtdd, J=23.1, 6.8, 3.9, 2.7 Hz, 2H, CFCH2), 2.45 (s, 3H, CH3); 13C NMR (125 MHz, DMSO-d6) δ: 165.9, 163.3, 156.3 (153.7, 151.5), 142.8, 130.5, 129.9 (129.5), 127.5, 126.9, 120.8, 28.7, 26.3 (26.1), 21.6); IR (KBr) ν: 1799, 1615, 1502, 1556, 1477, 1439, 1307, 1287, 1240, 1191, 1158, 1093, 1069 cm-1; ESI-MS m/z: 301.1 [M+H]+, 323.10 [M+Na]+, 339.80 [M+K]+. Anal. calcd for C13H11F3N2OS: C 52.00, H 3.69, N 9.33; found C 52.28, H 3.64, N 9.81.
2-(2-甲氧基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5h):白色固体, 收率78%. m.p. 35~36 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.87 (dd, J=7.8, 1.3 Hz, 1H, ArH), 7.52 (td, J=7.5, 1.4 Hz, 1H, ArH), 7.50~7.45 (m, 1H, ArH), 7.41 (td, J=7.7, 0.7 Hz, 1H, ArH), 3.53 (t, J=6.9 Hz, 2H, SCH2), 2.92 (dtdd, J=23.0, 6.8, 4.0, 2.7 Hz, 2H, CFCH2), 2.60 (s, 3H, OCH3); 13C NMR (125 MHz, DMSO-d6) δ: 165.9, 163.3, 154.1 (152.6, 151.8), 138.0, 132.3, 132.0, 129.1, 128.5, 127.0, 122.7, 28.6, 26.3 (26.2), 21.9); IR (KBr) ν: 1798, 1607, 1548, 1493, 1476, 1360, 1307, 1291, 1236, 1215, 1217, 1194, 1158, 1086 cm-1; ESI-MS m/z: 317.10 [M+H]+, 339.31 [M+Na]+. Anal. calcd for C13H11F3N2O2S: C 49.37, H 3.51, N 8.86; found C 50.84, H 3.57, N 8.79.
2-(2-羟基苯基)-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噁二唑(5i):淡黄色稠状固体, 收率77%. 1H NMR (500 MHz, DMSO-d6) δ: 10.26 (s, 1H, OH), 7.72 (dd, J=7.8, 1.7 Hz, 1H, ArH), 7.42 (ddd, J=8.4, 7.3, 1.7 Hz, 1H, ArH), 7.06 (d, J=9.0 Hz, 1H, ArH), 6.98~6.95 (m, 1H, ArH), 3.49 (t, J=6.9 Hz, 2H, SCH2), 2.92 (dtdd, J=22.9, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 165.1, 163.1, 156.6, 156.3 (153.7, 151.8), 133.9, 129.3, 129.0 (126.6), 120.1, 117.6, 109.9, 28.6, 26.2 (26.0); IR (KBr) ν: 3250, 1799, 1627, 1591, 1554, 1480, 1404, 1348, 1271, 1250, 1126, 1089, 1063, 1034, 1013 cm-1; ESI-MS m/z: 303.10 [M+H]+, 325.10 [M+Na]+. Anal. calcd for C12H9F3N2O2S: C 47.68, H 3.00, N 9.27; found C 47.66, H 2.97, N 9.29.
2-苯基-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6a):白色固体, 收率93%. m.p. 79~80 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.88~7.86 (m, 2H, ArH), 7.53~7.49 (m, 3H, ArH), 3.55 (t, J=6.8 Hz, 2H, SCH2), 2.85 (dtdd, J=23.0, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 168.6, 164.9, 155.9 (153.7, 151.8), 131.9, 130.0, 129.7, 129.1 (126.9), 128.0, 30.0, 26.0 (25.8); IR (KBr) ν: 1801, 1659, 1544, 1463, 1466, 1311, 1289, 1278, 1259, 1215, 1221, 1184, 1152, 1049 cm-1; ESI-MS m/z: 303.00 [M+H]+, 325.00 [M+Na]+. Anal. calcd for C12H9F3N2S2: C 47.67, H 3.00, N 9.27; found C 47.65, H 2.97, N 9.24.
2-(4-氟苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6b):白色固体, 收率54%. m.p. 82~84 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 7.96~7.93 (m, 2H, ArH), 7.38~7.35 (m, 2H, ArH), 3.53 (t, J=6.8 Hz, 2H, SCH2), 2.87 (dtdd, J=23.1, 6.8, 4.0, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 167.5, 165.3, 165.0, 163.3, 154.0 (151.8, 151.4), 130.5, 130.5, 129.1 (128.6), 126.3, 117.3, 117.1, 30.1, 26.0 (25.8); IR (KBr) ν: 1811, 1617, 1538, 1494, 1446, 1360, 1301, 1246, 1236, 1215, 1210, 1154, 1055, 1053 cm-1; ESI-MS m/z: 321.01 [M+H]+. Anal. calcd for C12H8F4N2S2: C 45.00, H 2.52, N 8.75; found C 44.91, H 2.84, N 8.84.
2-(4-硝基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6c):黄色固体, 收率87%. m.p. 72~74 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.39~8.36 (m, 2H, ArH), 8.20~8.18 (m, 2H, ArH), 3.62 (t, J=6.8 Hz, 2H, SCH2), 2.95 (dtdd, J=23.0, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 167.2, 166.5, 156.2 (154.0, 153.7), 149.2, 135.3, 129.2, 128.4 (126.9), 125.1, 30.1, 25.9 (25.8); IR (KBr) ν: 1801, 1611, 1549, 1359, 1351, 1303, 1290, 1281, 1066, 1053 cm-1; ESI-MS m/z: 348.00 [M+H]+, 370.10 [M+Na]+. Anal. calcd for C12H8F3N3O2S2: C 41.50, H 2.32, N 12.10; found C 41.64, H 2.57, N 12.54.
2-(2−氟苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6d):白色固体, 收率79%. m.p. 46~47 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.22 (td, J=7.7, 1.8 Hz, 1H, ArH), 7.65 (d, J=8.5 Hz, 1H, ArH), 7.49 (d, J=11.0 Hz, 1H, ArH), 7.44 (t, J=6.5 Hz, 1H, ArH), 3.60 (t, J=6.8, 2H, SCH2), 2.93(dtdd, J=23.0, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6)δ: 166.3, 160.7, 160.2, 158.2, 155.8 (154.0, 151.4), 133.9, 128.8, 127.2 (126.9), 126.1, 1117.6, 117.00, 30.0, 26.0 (25.9); IR (KBr) ν: 1810, 1617, 1608, 1499, 1486, 1355, 1304, 1241, 1236, 1213, 1210, 1194, 1048, 1046 cm-1; ESI-MS m/z: 321.00 [M+H]+, 343.00 [M+Na]+. Anal. calcd for C12H8F4N2S2: C 45.00, H 2.52, N 8.75; found C 44.98, H 2.81, N 8.34.
2-(2, 4-二氯苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6e):白色固体, 收率86%. m.p. 57~58 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.25 (d, J=8.5 Hz, 1H, ArH), 7.54 (s, 2H, ArH), 7.41~7.39 (m, 2H, ArH), 3.58 (t, J=6.8 Hz, 2H, SCH2), 2.93 (dtdd, J=21.5, 6.9, 4.0, 2.6 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 166.1, 163.0, 155.9 (154.0, 151.8), 137.3, 133.0, 132.2, 131.6, 130.4, 128.0, 127.4, 125.8, 29.6, 26.3 (26.1); IR (KBr) ν: 1797, 1584, 1554, 1478, 1438, 1405, 1383, 1367, 1299, 1288, 1232, 1218, 1148, 1109 cm-1; ESI-MS m/z: 372.00 [M+H]+, 394.20 [M+Na]+. Anal. calcd for C12H7Cl2F3N2S2: C 38.83, H 1.90, N 7.55; found C 38.56, H 1.92, N 7.33.
2-(4-三氟甲基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6f):白色固体, 收率81%. m.p. 39~41 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.13 (d, J=8.2 Hz, 2H, ArH), 7.91 (d, J=8.3 Hz, 2H, ArH), 3.51 (t, J=6.8 Hz, 2H, SCH2), 2.87 (dtdd, J=23.0, 6.8, 3.9, 2.7 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6)δ: 167.1 (166.4), 164.7, 155.5 (154.0, 153.6), 132.2 (131.9), 127.8, 127.3, 126.9, 125.3, 123.1, 28.7, 26.2 (26.1); IR (KBr) ν: 1801, 1607, 1548, 1493, 1476, 1360, 1317, 1291, 1236, 1217, 1215, 1194, 1158, 1086 cm-1; ESI-MS m/z: 371.11 [M+H]+, 393.10 [M+Na]+. Anal. calcd for C13H8F6N2S2: C 42.16, H 2.18, N 7.56; found C 41.75, H 2.19, N 7.51.
2-(4-甲基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6g):白色固体, 收率86%. m.p. 45~47 ℃. 1H NMR (500 MHz, DMSO-d6) δ: 7.76 (d, J=7.5 Hz, 2H, ArH), 7.32 (d, J=7.7 Hz, 2H, ArH), 3.52 (t, J=6.8 Hz, 2H, SCH2), 2.88 (dtdd, J=23.1, 6.8, 3.9, 2.7 Hz, 2H, CFCH2), 2.35 (s, 3H, CH3); 13C NMR (125 MHz, DMSO-d6) δ: 168.7, 164.3, 156.2 (153.7, 152.7), 142.1, 130.6, 129.1 (128.7), 128.0, 127.0, 30.0, 26.0 (25.8), 21.7); IR (KBr) ν: 1799, 1607, 1449, 1438, 1404, 1374, 1301, 1249, 1181, 1090, 1050, 1001 cm-1; ESI-MS m/z: 317.01 [M+H]+, 339.00 [M+Na]+. Anal. calcd for C13H11F3N2S2: C 49.36, H 3.50, N 8.86; found C 49.38, H 3.96, N 9.29.
2-(2-甲氧基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6h):白色固体, 收率87%. m.p. 43~44 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.23 (dd, J=7.8, 1.7 Hz, 1H, ArH), 7.54~7.51 (m, 1H, ArH), 7.24 (d, J=8.5 Hz, 1H, ArH), 7.12 (t, J=7.5 Hz, 1H, ArH), 3.95 (s, 3H, OCH3), 3.51 (t, J=6.8 Hz, 2H, SCH2), 2.86 (dtdd, J=23.1, 13.1, 6.5, 3.2 Hz, 2H, CFCH2); 13C NMR (125 MHz, DMSO-d6) δ: 165.1, 162.1, 155.9, 154.0 (153.7, 151.8), 133.2, 127.7, 127.2 (126.9), 121.8, 118.4, 113.0, 56.7, 29.8, 26.1 (25.9); IR (KBr) ν: 1796, 1601, 1584, 1503, 1466, 1420, 1372, 1291, 1244, 1150, 1120, 1088, 1058, 1025 cm-1; ESI-MS m/z: 333.11 [M+H]+, 355.10 [M+Na]+. Anal. calcd for C13H11F3N2OS2: C 46.98, H 3.34, N 8.43; found C 46.25, H 3.56, N 8.68.
2-(2-羟基苯基)-5-[(3, 4, 4-三氟-3-丁烯-1-基)-硫]-1, 3, 4-噻二唑(6i):白色固体, 收率81%. m.p. 97~98 ℃; 1H NMR (500 MHz, CDCl3) δ: 11.06 (s, 1H, OH), 7.37 (dd, J=7.4, 6.7 Hz, 2H, ArH), 7.10 (d, J=8.6 Hz, 1H, ArH), 6.94 (t, J=7.5 Hz, 1H, ArH), 3.57 (t, J=6.8 Hz, 2H, SCH2), 2.91 (dtdd, J=23.0, 6.8, 3.9, 2.8 Hz, 2H, CFCH2); 13C NMR (125 MHz, CDCl3) δ: 170.4, 162.9, 157.0, 156.3 (154.1, 153.7), 132.9, 129.6, 127.4 (125.6), 120.1, 118.1, 113.9, 29.6, 26.1 (26.0); IR (KBr) ν: 3350, 1798, 1607, 1557, 1483, 1466, 1352, 1337, 1298, 1226, 1213, 1215, 1174, 1160, 1066 cm-1; ESI-MS m/z: 319.01 [M+H]+, 341.20 [M+Na]+. Anal. calcd for C12H9F3N2OS2: C 45.28, H 2.85, N 8.80; found C 45.14, H 3.07, N 9.06.
3.3 生物活性测定
3.3.1 目标化合物对秀丽线虫的毒杀活性
按文献[21]报道的方法获得用于活性测试的秀丽线虫的二龄幼虫, 以商品药剂噻唑磷和氟噻虫砜为阳性对照, 清水为空白对照, 采用毒杀法测定目标化合物对秀丽线虫的毒杀活性[22].每个药剂三次平行, 三次重复实验, 统计施药24、48、72 h后线虫的死亡情况.利用以下公式计算线虫的校正死亡率.
3.3.2 目标化合物对柑橘线虫的毒杀活性
柑橘线虫土壤的分离与富集和文献[23, 24]报道的方法基本一致.用改进文献[25]的方法从土壤中获得柑橘线虫, 即提前一天准备好分离所用的土壤, 将其中的小石块和杂物除去, 根系用剪刀轻轻剪碎, 混合均匀.准备好4个干净的纱布(每个含两层), 称取土壤约4×500, 将试样的土壤分装到四个纱布中, 包裹起来, 并用橡皮筋扎包扎, 以防止土壤漏出, 包裹好后放置在直径为150 mm的玻璃漏斗中, 将漏斗放置于铁架或木制漏斗架的圆环内, 下端连接一端乳胶管, 末端用止水夹控制胶管的开闭.向漏斗内注入少量的清水, 令水漫过包裹土壤样品的纱布. 24 h后(时间不宜过长, 时间太长线虫可能缺氧而死)线虫由于其趋水性和自身的重量下沉至漏斗下的乳胶管中, 用培养皿或试管接在乳胶管下, 松开止水夹放出约10 mL的水, 收集得线虫悬浮液, 分装到15 mL的离心管中, 于离心机上4000 r/min离心4 min.去上层清液, 保留1 mL左右, 取约10 μL的线虫浓缩液于电子显微镜下观察, 数量约30~60头左右即可, 若线虫数量不足, 则继续浓缩.利用第3.3.1节下的方法测定目标化合物对柑橘线虫的毒杀活性.
辅助材料(Supporting Information) 化合物5a~5i和6a~6i的1H NMR和13C NMR图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Caboni, P.; Saba, M.; Tocco, G.; Casu, L.; Murgia, A.; Maxia, A.; Menkissoglu-Spiroudi, U.; Ntalli, N. J. Agric. Food Chem. 2013, 61, 9784. doi: 10.1021/jf403684h
-
[2]
Jang, J. Y.; Dang, Q. L.; Choi, Y. H.; Choi, G. J.; Soo, J. K.; Cha, B.; Luu, N. H.; Kim, J. C. J. Agric. Food Chem. 2015, 63, 68. doi: 10.1021/jf504572h
-
[3]
Dang, Q. L.; Kim, W. K.; Nguyen, C. M.; Choi, Y. H.; Choi, G. J.; Jang, K. S.; Park, M. S.; Lim, C. H.; Luu, N. H.; Kim, J. C. J. Agric. Food Chem. 2011, 59, 11160. doi: 10.1021/jf203017f
-
[4]
Chitwood, D. J. Pest Manage. Sci. 2003, 59, 748. doi: 10.1002/(ISSN)1526-4998
-
[5]
Caboni, P.; Saba, M.; Tocco, G.; Casu, L.; Murgia, A.; Maxia, A.; Menkissoglu-Spiroudi, U.; Ntalli, N. J. Agric. Food Chem. 2013, 61, 9784. doi: 10.1021/jf403684h
-
[6]
Aissani, N.; Urgeghe, P. P.; Oplos, C.; Saba, M.; Tocco, G.; Petretto, G. L.; Eloh, K.; Menkissoglu-Spiroudi, U.; Ntalli, N.; Caboni, P. J. Agric. Food Chem. 2015, 63, 6120. doi: 10.1021/acs.jafc.5b02425
-
[7]
陆青, 沈巧英, 孙璐, 王佳毅, 宋恭华, 有机化学, 2016, 36, 760. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345462.shtmlLu, Q.; Shen, Q. Y.; Sun, L.; Wang, J. Y.; Song, G. H. Chin. J. Org. Chem. 2016, 36, 760(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345462.shtml
-
[8]
Black, L. A.; Basha, A.; Kolasa, T.; Kort, M. E.; Liu, H.; McCarty, C. M.; Stewart, A. O. WO 2000024719, 2000[Chem. Abstr. 2000, 132, 321867].
-
[9]
蒋强, 徐卫国, 李华, 陈忠民, 戴佳亮, 杨汪松, 有机氟工业, 2012, (3), 42. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmJiang, Q.; Xu, W. G.; Li, H.; Chen, Z. M.; Dai, J. L.; Yang, W. S. Organo-Fluorine Ind. 2012, (3), 42(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[10]
Oka, Y.; Shuker, S.; Tkachi, N. Pest Manage. Sci. 2012, 68, 268. doi: 10.1002/ps.v68.2
-
[11]
Oka, Y.; Shuker, S.; Tkachi, N. Pest Manage. Sci, 2009, 65, 1082. doi: 10.1002/ps.v65:10
-
[12]
杜海堂, 杜海军, 有机化学, 2010, 30, 137. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338438.shtmlDu, H. T.; Du, H. J. Chin. J. Org. Chem. 2010, 30, 137(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract338438.shtml
-
[13]
刘建超, 王卫东, 贺红武, 有机化学, 2014, 34, 1447. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344394.shtmlLiu, J. C.; Wang, W. D.; He, H. W. Chin. J. Org. Chem. 2014, 34, 1447(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344394.shtml
-
[14]
Wang, B. L.; Zhu, H. W.; Li, Z. M.; Xiong, L. X.; Li, Y. Q.; Zhao, Y.; Zhang, J. F.; Chen, Y. W.; Zhou, S.; Li, Z. M. J. Agric. Food Chem. 2013, 61, 5483. doi: 10.1021/jf4012467
-
[15]
Mo, Q. J.; Liu, L. Z.; Duan, W. G.; Cen, B.; Lin, G. S.; Chen, N. Y.; Huang, Y.; Liu, B. M. Chem. Ind. For. Prod. 2015, 35, 8.
-
[16]
石玉军, 李阳, 方源, 陈佳, 叶林玉, 葛书山, 戴红, 有机化学, 2016, 36, 2472. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345611.shtmlShi, Y. J.; Li, Y.; Fang, Y.; Chen, J.; Ye, L. Y.; Ge, S. S.; Dai, H. Chin. J. Org. Chem. 2016, 36, 2472(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345611.shtml
-
[17]
Li, P.; Shi, L.; Gao, M. N.; Yang, X.; Xue, W.; Jin, L. H.; Hu, D. Y.; Song, B. A. Bioorg. Med. Chem. Lett. 2015, 25, 481. doi: 10.1016/j.bmcl.2014.12.038
-
[18]
Li, P.; Shi, L.; Yang, X.; Chen, X. W.; Wu, F.; Shi, Q. C.; Xu, W. M.; He, M.; Hu, D. Y.; Song, B. A. Bioorg. Med. Chem. Lett. 2014, 24, 1677. doi: 10.1016/j.bmcl.2014.02.060
-
[19]
Gan, X. H.; Hu, D. Y.; Li, P.; Wu, J.; Chen, X. W.; Xue, W.; Song, B. A. Pest Manage. Sci. 2016, 72, 534. doi: 10.1002/ps.2016.72.issue-3
-
[20]
Xu, W. M.; Yang, S.; Bhadury, P.; He, J.; He, M.; Gao, L. L.; Hu, D. Y.; Song, B. A. Pestic. Biochem. Physiol. 2011, 101, 6. doi: 10.1016/j.pestbp.2011.05.006
-
[21]
唐晓明, 硕士论文, 长春理工大学, 沈阳, 2012.Tang, X.-M. M.S. Thesis, Changchun University of Science and Technology, Shenyang, 2012(in Chinese).
-
[22]
Aissani, N.; Urgeghe, P. P.; Oplos, C.; Saba, M.; Tocco, G.; Petretto, G. L.; Eloh, K.; Menkissoglu-Spiroudi, U.; Ntalli, N.; Caboni, P. J. Agric. Food Chem. 2015, 63, 6120. doi: 10.1021/acs.jafc.5b02425
-
[23]
Khan, M.; Tahir, M.; Munir, A.; Ataulah; Khan, N. H. J. Agric. Vol. 2010, 26, 271.
-
[24]
Irshad, U.; Mukhtar, T.; Ashfaq, M.; Kayani, M. Z.; Kayani, S. B.; Hanif, M.; Aslam, S. J. Anim. Plant Sci, 2012, 4, 1014.
-
[25]
Chawla, M. L.; Prasad, S. K. Indian J. Nematol. 1975, 4, 115.
-
[1]
-
表 1 不同反应条件对目标化合物5a合成收率的影响
Table 1. Effects of reaction conditions on the synthesis of the target compound 5a
Entry Solvent Acid-accepter Reaction temperature Reaction time/h Yield/% 1 DMF KOH Room temperature 39 86 2 Acetone KOH Room temperature 25 88 3 CH3CN KOH Room temperature 22 86 4 Acetone NaOH Reflux 2.5 84 5 CH3CN NaOH Reflux 2.0 87 6 CH3CN K2CO3 Reflux 2.5 87 7 Acetone K2CO3 Reflux 2.5 87 表 2 目标化合物对秀丽线虫的离体活性(200 µg/mL)
Table 2. Nematicidal activity of title compounds against C. elegans in vitro (200 µg/mL)
Compd. 校正死亡率/% 24 h 48 h 72 h 5a 66.4±0.4 91.5±0.8 95.4±4.1 5b 61.1±2.4 58.9±2.4 76.2±2.7 5c 27.4±1.3 58.0±4.3 54.4±1.5 5d 37.9±6.2 75.0±3.2 95.5±2.2 5e 51.7±4.6 76.9±1.1 95.8±2.1 5f 61.3±0.5 74.8±5.4 100.0±0.0 5g 58.2±1.6 79.6±0.9 98.4±1.3 5h 58.7±3.9 85.1±0.1 87.4±2.2 5i 67.3±1.1 94.0±2.6 97.7±2.0 6a 1.8±3.1 88.4±1.0 100.0±0.0 6b 47.9±5.0 91.8±3.6 100.0±0.0 6c 17.7±3.5 75.1±3.6 94.6±1.6 6d 37.2±3.0 88.4±6.5 100.0±0.0 6e 22.5±4.6 26.8±2.1 88.3±19.4 6f 33.6±4.4 94.6±1.5 100.0±0.0 6g 29.9±6.7 67.8±2.6 100.0±2.5 6h 59.1±1.9 64.1±2.2 73.0±6.6 6i 8.6±3.4 7.3±0.8 68.4±2.6 噻唑磷 39.3±2.3 59.9±3.1 87.5±2.2 氟噻虫砜 37.3±4.7 60.4±3.9 86.4±2.7 表 3 部分目标化合物对秀丽线虫的致死中浓度LC50
Table 3. LC50 values of some compounds against C. elegans in vitro
Compd. 24 h 48 h y=ax+b LC50/(µg•mL-1) r y=ax+b LC50/(µg•mL-1) r 5a 0.2561x+4.4233 178.59±1.44 0.4760 0.5889x+4.2104 21.92±2.09 0.7176 5b 1.0746x+2.4188 252.35±0.03 0.9174 1.3985x+2.4206 69.89±1.01 0.9904 5d 0.8283x+3.0091 253.28±0.73 0.9347 1.1520x+2.9093 74.94±3.40 0.9430 5e 1.2753x+2.2218 150.82±0.03 0.9077 1.3583x+2.5460 64.07±5.97 0.9155 5f 1.1755x+1.9598 385.75±0.61 0.8958 1.3051x+2.5362 77.24±0.12 0.9567 5g 1.3294x+2.0799 157.24±0.27 0.9834 1.3294x+2.0799 157.24±0.27 0.9834 5h 1.2534x+1.9359 278.38±0.12 0.9712 1.2528x+2.2710 150.77±0.31 0.9275 6a 1.0749x+2.1040 494.54±2.15 0.8546 1.4246x+2.0135 124.85±6.78 0.9365 6b 1.2812x+2.1805 158.73±0.07 0.9473 0.8287x+3.6305 44.94±9.07 0.9136 6c 1.8643x+0.5573 241.57±1.61 0.9243 1.6076x+1.7553 104.62±3.75 0.9849 6d 3.0666x−1.7362 157.27±0.91 0.9732 2.4063x+0.2403 95.06±1.16 0.9483 6f 2.5168x−0.6585 177.13±1.04 0.8863 2.3477x+0.1335 118.27±5.65 0.9656 6g 1.6108x+1.5416 140.28±0.09 0.9396 1.3250x+2.5826 66.75±4.86 0.8893 噻唑磷 1.5526x+1.8895 100.78±1.27 0.9878 1.0929x+2.9667 72.52±3.15 0.9675 氟噻虫砜 1.2150x+2.4961 115.03±1.27 0.8989 0.9481x+3.2334 86.44±3.85 0.9972 表 4 部分化合物对柑橘的毒杀活性(100 µg/mL)
Table 4. Nematicidal activity of some compounds against T. semipenetrans in vitro (100 µg/mL)
Compd. 校正死亡率/% 48 h 72 h 5b 79.9±2.2 96.7±2.5 5c 65.5±6.5 81.8±2.6 5d 74.5±5.4 87.3±4.4 5e 68.1±6.1 79.8±2.9 5f 67.3±4.1 78.7±6.0 6b 78.5±5.2 85.9±8.3 6d 75.9±7.8 80.3±5.5 6f 42.7±4.6 79.8±6.0 噻唑磷 67.9±4.4 84.5±1.7 氟噻虫砜 58.7±0.1 76.9±0.2 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1436
- HTML全文浏览量: 139


 下载:
下载:

 下载:
下载:

