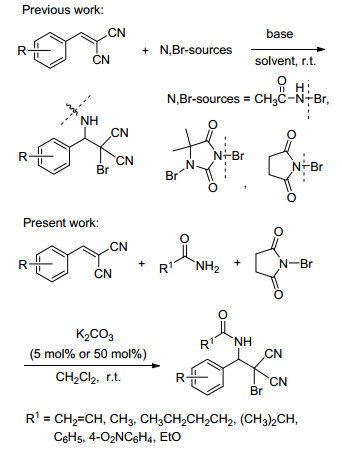
 图式 1
由β, β-二氰基苯乙烯衍生物合成邻溴代胺的不同策略
Scheme1.
Different strategy for the synthesis of vicinal bromoamines from β, β-dicyanostyrene derivatives
图式 1
由β, β-二氰基苯乙烯衍生物合成邻溴代胺的不同策略
Scheme1.
Different strategy for the synthesis of vicinal bromoamines from β, β-dicyanostyrene derivatives

Citation: Kang Meng, Hui Wenping, Hou Dan, Chen Zhanguo. Synthesis of Vicinal Bromoamine Compounds via Three Components Reaction of β, β-Dicyanostyrene/Amide/N-Bromo-succinimide[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2962-2971. doi: 10.6023/cjoc201703015

β, β-二氰基苯乙烯/酰胺/N-溴代丁二酰亚胺三组分合成相应的邻溴代胺
-
关键词:
- 邻溴代胺
- / β, β-二氰基苯乙烯
- / 酰胺
- / N-溴代丁二酰亚胺
English
Synthesis of Vicinal Bromoamine Compounds via Three Components Reaction of β, β-Dicyanostyrene/Amide/N-Bromo-succinimide
-
Key words:
- vicinal bromoamine
- / β, β-dicyanostyrene derivative
- / amide
- / N-bromo-succinimide
-
邻卤代胺是分子中同时具有卤素和氨基且处于相邻位置的双官能团化合物, 由于氨基具有亲核性, 而卤素容易离去, 易被其它亲核试剂所取代, 因而在有机合成中是一个用途很广的合成中间体.例如, 在一定条件下, 当此类分子与其它亲核试剂作用时, 可发生分子间的亲核取代反应, 卤素被取代形成新的官能团.在一定条件下, 邻卤代胺也可发生分子内的亲核取代反应形成氮丙啶[1~4], 而氮丙啶本身又是一类重要的有机合成子, 可通过开环、扩环反应形成很多特殊结构的化合物[5~9].邻卤代胺在一定条件下, 还会脱去一分子卤化氢得到氨基烯, 即α, β-脱氢氨[10~16], 由于这类物质结构中有活性官能团碳碳双键存在, 进而可再发生双键上的加成反应及Diels-Alder反应等.文献研究表明, 合成邻卤代胺的最重要方法是通过烯烃的氨卤化过程而实现的, 烯键上的氨卤化反应的发现可追溯到20世纪30年代末, 著名的有机化学家Kharasch等[17]在研究不对称烯烃的HBr加成时首次发现了这个反应.几十年后, 由于催化剂的发现, 使得原本收率不高几乎被忘却的这个反应重新得到了重视.在催化剂的催化下, 新的氮源、卤源与各种不同结构的烯烃均能高收率地形成邻卤代胺[18].到目前为止, 研究最多的烯烃是普通烯烃(包括链烯和环烯)[19, 20]、查尔酮类[21~26]、肉桂酸酯类和硝基烯类[27~33], 而研究最多的氮源和卤素源是N-卤代的磺酰胺类[19, 25~28, 34, 35].本课题组在前期的研究中, 发现β, β-二氰基苯乙烯衍生物也能与N-溴代的碳酰胺, 如N-溴代乙酰胺[36]、1, 3-二溴-5, 5-二甲基海因[37]、N-溴代丁二酰亚胺[38]等发生氨溴加成反应, 形成邻溴代胺.但以上氮卤源均需将相应的酰胺先转化成N-溴代的酰胺.三组分反应是一种能提高反应效率的常用策略, 本课题组曾研究过缺电子烯烃β-硝基苯乙烯衍生物与丙烯酰胺及N-溴代丁二酰亚胺三组分的氨溴加成反应[39], 以及缺电子烯烃α-氰基肉桂酸乙酯衍生物与酰胺及N-溴代丁二酰亚胺的一锅法三组分合成2-噁唑啉的反应[40].该策略的最大优点在于反应中把酰胺和N-溴代丁二酰亚胺(NBS)原位转化成最重要的反应原料N-溴代的酰胺, 提高了反应效率. 2016年, Soliman研究小组[41]也报道了类似的方法, 将Cl3SiN3和NBS原位转化成BrN3, 在乙腈溶剂中与β, β-二氰基苯乙烯衍生物反应, 得到邻溴代叠氮的化合物.受文献[41]的启示, 为了拓宽β, β-二氰基苯乙烯衍生物氨溴加成反应的适应范围, 建立一个反应条件温和, 操作容易且原料易得的新体系, 本研究以β, β-二氰基苯乙烯衍生物作为反应底物, 各种酰胺作为氮源、N-溴代丁二酰亚胺作为卤素源, 探索了三组分一锅法构建相应邻溴代胺的反应.经过系统研究, 建立了β, β-二氰基苯乙烯/酰胺/NBS三组分合成相应邻溴代胺的新方法.实验结果表明, 该方法不仅对β, β-二氰基苯乙烯衍生物有广泛的适应性, 同时对各种酰胺也有广泛的适应性, 如丙烯酰胺、乙酰胺、戊酰胺、异丁酰胺、苯甲酰胺、对硝基苯甲酰胺和乌来糖等(Scheme 1).
 图式 1
由β, β-二氰基苯乙烯衍生物合成邻溴代胺的不同策略
Scheme1.
Different strategy for the synthesis of vicinal bromoamines from β, β-dicyanostyrene derivatives
图式 1
由β, β-二氰基苯乙烯衍生物合成邻溴代胺的不同策略
Scheme1.
Different strategy for the synthesis of vicinal bromoamines from β, β-dicyanostyrene derivatives
1 结果与讨论
1.1 条件优化
通常情况下, 化学反应主要受溶剂、物料比、催化剂及催化剂用量的影响.为了建立β, β-二氰基苯乙烯衍生物、酰胺、NBS三组分合成相应邻溴代胺的新方法, 本研究对上述反应条件进行了优化.选用Na2CO3 (110 mol%)作为促进剂, β, β-二氰基苯乙烯(1a)作为反应底物, 以丙烯酰胺2a作为氮源, NBS 3作为卤源, 在常温常压下, 且当物料比为n(1a):n(2a):n(3)=1:2:2时, 首先对溶剂进行了考察, 结果见表 1.由表 1可知, 在所筛选的普通溶液剂中(表 1, Entries 1~7), 发现极性大的溶剂不利于该反应的进行, 如当溶剂为N, N-二甲基甲酰胺(DMF)和甲醇时, 即使常温搅拌24 h也没有观察到有目标产物生成(表 1, Entries 1~2).当溶剂为乙腈和丙酮时, 该反应能给出中等收率的4aa(表 1, Entries 3~4, 42%~60%).当溶剂为四氢呋喃、氯仿和二氯甲烷时, 该反应能给出非常满意收率的4aa(表 1, Entries 5~7, 84%~95%).对比反应收率, 确定CH2Cl2作为该反应的有效溶剂.在确定溶剂之后, 对反应的物料比也进行了优化(表 1, Entries 7~9), 发现物料比为n(1a):n(2a):n(3)=1:1.5:1.5时, 该反应也能给出91%收率的4aa.为了获得最佳反应条件, 本研究对碱的种类也进行了筛选(表 1, Entries 9~14), 发现K2CO3作为促进剂时, 反应完成所需的时间最短, 产率最高(表 1, Entry 14, 收率91%, 1.5 h).为了进一步优化反应条件, 本研究对K2CO3的用量也进行了对比研究(表 1, Entries 14~18), 发现2 mol% K2CO3便可有效催化该反应的进行(表 1, Entry 18, 收率93%, 反应时间10 h), 考虑到反应时间的关系, 最后确定催化剂的最佳用量为5 mol%(表 1, Entry 17, 收率93%, 反应时间3.5 h).对比实验证明, 不加碱, 反应24 h也只能得到22%的收率(表 1, Entry 19), 说明催化剂对该反应有着至关重要的作用.
 表 1
溶剂、物料比、碱及其用量对β, β-二氰基苯乙烯与丙烯酰胺、NBS的氨溴加成反应的影响a
Table 1.
Effect of solvent, the ratio of starting materials, base as well as its loading to the aminobromination of β, β-dicyanostyrene with acrylamide and NBS
表 1
溶剂、物料比、碱及其用量对β, β-二氰基苯乙烯与丙烯酰胺、NBS的氨溴加成反应的影响a
Table 1.
Effect of solvent, the ratio of starting materials, base as well as its loading to the aminobromination of β, β-dicyanostyrene with acrylamide and NBS

Entry Solvent Base (mol%) Ratio t/h Yieldb/% 1 DMF Na2CO3 (110) 1:2:2 24 NP 2 CH3OH Na2CO3 (110) 1:2:2 24 NP 3 CH3CN Na2CO3 (110) 1:2:2 0.33 42 4 Acetone Na2CO3 (110) 1:2:2 0.33 60 5 THF Na2CO3 (110) 1:2:2 0.33 84 6 CHCl3 Na2CO3 (110) 1:2:2 5 90 7 CH2Cl2 Na2CO3 (110) 1:2:2 3 95 8 CH2Cl2 Na2CO3 (110) 1:1.1:1.1 4 82 9 CH2Cl2 Na2CO3 (110) 1:1.5:1.5 3 91 10 CH2Cl2 KOH (110) 1:1.5:1.5 2 72 11 CH2Cl2 NaOH (110) 1:1.5:1.5 2 77 12 CH2Cl2 K3PO4 (110) 1:1.5:1.5 1.5 55 13 CH2Cl2 NaOAc (110) 1:1.5:1.5 2 85 14 CH2Cl2 K2CO3 (110) 1:1.5:1.5 1.5 91 15 CH2Cl2 K2CO3(50) 1:1.5:1.5 1.5 92 16 CH2Cl2 K2CO3(10) 1:1.5:1.5 1.5 92 17 CH2Cl2 K2CO3(5) 1:1.5:1.5 3.5 93 18 CH2Cl2 K2CO3(2) 1:1.5:1.5 10 93 19 CH2Cl2 - 1:1.5:1.5 24 22 aReaction conditions: substrate (1.0 mmol), acrylamide (1.1~2 mmol), NBS (1.1~2 mmol), base (2~110 mol%), solvent (10 mL), room temperature; bIsolated yield after column chromatographic separation; NP: no product was observed. 上述实验结果表明, 反应的优化条件是:催化剂为K2CO3 (5 mol%, 相对于β, β-二氰基苯乙烯), 物料比为n(1a):n(2a):n(3)=1:1.5:1.5, 溶剂为CH2Cl2, 室温搅拌反应.
1.2 底物结构对反应的影响
为了探索该反应对底物的适应性以及反应的可能机理, 在上述优化条件下, 对13种β, β-二氰基苯乙烯衍生物与丙烯酰胺、NBS的反应情况进行了系统考察, 结果见表 2.
 表 2
β, β-二氰基苯乙烯衍生物与丙烯酰胺、NBS的氨溴加成反应a
Table 2.
K2CO3-catalyzed aminobromination of β, β-dicyano-styrene derivatives reacted with acrylamide and NBS
表 2
β, β-二氰基苯乙烯衍生物与丙烯酰胺、NBS的氨溴加成反应a
Table 2.
K2CO3-catalyzed aminobromination of β, β-dicyano-styrene derivatives reacted with acrylamide and NBS

Entry 1 Ar Product 4 T/h Yieldb/% 1 1a C6H5 4aa 3.5 93 2 1b 4-CH3C6H4 4ba 2.5 92 3 1c 3-CH3C6H4 4ca 4 85 4 1d 4-CH3OC6H4 4da 8 50 5 1e 3-CH3OC6H4 4ea 1.5 87 6 1f 3, 5-(CH3O)2C6H3 4fa, 4fa* 2 40c, 46d 7 1g 1-Naphthyl 4ga 24 91 8 1h 3, 4, 5-(CH3O)3C6H2 4ha 24 35 9 1i 4-FC6H4 4ia 0.5 80 10 1j 4-ClC6H4 4ja 0.7 85 11 1k 4-BrC6H4 4ka 0.5 80 12 1l 4-O2NC6H4 4la 2 87 13 1m 4-(CH3)2NC6H4 4ma 24 NP aReaction conditions: the β, β-dicyanostyrene derivatives (1 mmol), acrylamide (1.5 mmol), NBS (1.5 mmol), K2CO3 (5 mol%, molar fraction), CH2Cl2(10 mL), room temperature.; bIsolated yield after column chromatographic separation. cNormal addition product. dAddition product is a aromatic substituted products; NP: no product was observed. 由表 2可知, 在考察的13种β, β-二氰基苯乙烯衍生物中, 除了苯环上带有氨基之外(表 2, Entry 13), 不论苯环上带有吸电了基还是给电子基, 在优化反应条件下, 均能与丙烯酰胺和NBS顺利发生反应, 并且以较高的收率得到相应的邻溴代胺, 最高收率可达93%.值得注意的是, 对于β, β-二氰基苯乙烯衍生物1f, 实验中得到了两种产物.一种是正常的邻溴代胺产物4fa, 而另一种除了在双键处形成邻溴代胺结构以外, 同时在苯环的4-位处有溴代反应发生, 形成了另一种产物4fa* (Eq. 1).此现象说明, 在反应中, NBS中的N-Br发生了异裂, 从而产生Br+ .苯环3, 5位连有的OCH3是两个强给电子基, 使得4位的电子密度增大, 4-位H很容易被Br+ 所取代, 生成4fa*.这个实验结果说明了在三组分反应中, 首先酰胺与NBS可发生氢溴交换反应, 原位生成N-溴代酰胺, 后者与烯烃发生加成反应得到相应产物.
1.3 酰胺结构对反应的影响
为了探讨反应对不同酰胺的适用性, 本研究以β, β-二氰基苯乙烯(1a)为底物, 以NBS (3)为溴源, 在相同反应条件下对各种不同结构的酰胺进行了三组分反应考察, 结果见表 3.由表 3可知, 乙酰胺、戊酰胺、异丁酰胺、苯甲酰胺、对硝基苯甲酰胺等五种酰胺均能顺利与β, β-二氰基苯乙烯(1a)和NBS (3)发生三组分反应, 高收率的得到相应邻溴代胺化合物.这一结果证明, 所建立的三组分一锅法, 不仅对β, β-二氰基苯乙烯衍生物具有广泛的适应性, 同时对酰胺也有广泛的适应性.
 表 3
β, β-二氰基苯乙烯1a与酰胺、NBS的氨溴加成反应a
Table 3.
Aminobromination of β, β-dicyanostyrene 1a reacted with amides and NBS
表 3
β, β-二氰基苯乙烯1a与酰胺、NBS的氨溴加成反应a
Table 3.
Aminobromination of β, β-dicyanostyrene 1a reacted with amides and NBS

Entry 1 Amide R1 Product 4 t/h Yieldb/% 1 1a 2b CH3 4ab 0.5 93 2 1a 2c CH2CH2CH2CH3 4ac 8 82 3 1a 2d CH(CH3)2 4ad 6 66 4 1a 2e C6H5 4ae 2 81 5 1a 2f 4-O2NC6H4 4af 18 50 aReaction conditions: the β, β-dicyanostyrene (1a) (1 mmol), amides 2b~2f (1.5 mmol), NBS 3 (1.5 mmol), K2CO3 (5 mol%, molar fraction), CH2Cl2(10 mL), room temperature; bIsolated yield after column chromatographic separation. 1.4 卤源对反应的影响
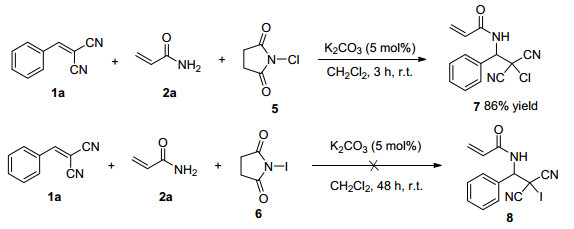
为了探究卤源的适用性, 本研究以β, β-二氰基苯乙烯(1a)为反应底物, 仍以丙烯酰胺(2a)作为氮源, 用N-氯代丁二酰亚胺(NCS, 5)和N-碘代丁二酰亚胺(NIS, 6)分别代替NBS (3), 在相同条件下考察了它们的反应情况, 结果见Scheme 2.
由Scheme 2可知, 在相同的反应条件下, β, β-二氰基苯乙烯(1a)与丙烯酰胺(2a)和NCS (5)反应3 h, 可顺利得到相应的邻氯代胺化合物7(产率86%).然而, 在相同的反应条件下, 当用NIS (6)代替NBS (3)时, 即使反应48 h也没有观察到有目标产物8生成, 说明NIS不适合该反应.但仔细观察反应体系, 发现溶液的颜色加深, 变为紫红色, 据此推测NIS在此条件下可能分解出I2.为了证实这一推测, 再次重复了该实验, 当反应进行到3 h时, 发现溶液的颜色已变成紫红色, 取几滴溶液加到淀粉溶液中, 发现淀粉溶液变蓝, 证明反应液中生成了I2.这样的结果证实NIS不是以碘离子的形成参与反应, 因而不能得到邻碘代胺化合物.至于NIS为什么在此条件下会发生分解形成I2目前还不清楚.
1.5 乌来糖参与的反应
乌来糖是同时具有酯基和酰氨基的双官能团化合物, 它既可以酰氨基参与反应, 也可以以酯基参与反应, 因此是一个很有用的反应试剂.为了探索β, β-二氰基苯乙烯衍生物与乌来糖、NBS的三组分反应情况, 本研究以β, β-二氰基苯乙烯(1a)为反应底物, 乌来糖为氮源, 以NBS为溴源作为反应模型, 考察了其反应情况.经过反应条件优化后, 发现当物料比为n(1a):n(2g):n(3)=1:2:2, 碱量提高到50 mol%时, 能够得到65%的邻溴代胺4ag.虽然反应活性不如其它酰胺, 但采用乌来糖作为氮源时, 可为烯键上引入三种不同的官能团, 增加邻溴代胺的应用范围.为了探讨该反应的适应性, 本研究也考察了13种不同的β, β-二氰基苯乙烯类衍生物与乌来糖、NBS的反应(表 4).由表 4可以看出, 绝大部分β, β-二氰基苯乙烯类衍生物与乌来糖、NBS在优化条件下可顺利形成相应的邻溴代胺, 并且在较短时间内, 以中等收率形成目标化合物.必须说明的是, 实验中发现, 当反应时间延长时, 形成的产物会有所分解.为此, 我们用平行实验比较收率的方法, 确定了反应的最佳反应时间.实验结果表明, 该反应时间不宜超过4 h.对比实验结果发现, 对于底物1l, 当其与丙烯酰胺、NBS一锅法反应时, 可以得到87%的相应产物.而当其与乌来糖、NBS一锅法, 在相似的反应条件下, 反应24 h, 却未能观察到有原料消耗, 这一现象虽然目前还无法解释, 但这一结果提示我们, 酰胺结构不同, 反应的情况有差别.而对于底物1m, 即在苯环上带有氨基时, 在相似的反应条件下, 不论与哪种酰胺作用(表 2, Entry 13和表 4, Entry 13), 虽然原料消耗了, 但都没有观察到有相应的产物形成, 说明活泼基团氨基的存在, 不适合该类反应.是否氨基受到NBS的氧化, 有待进一步研究.
 表 4
β, β-二氰基苯乙烯衍生物与乌来糖、NBS的氨溴加成a
Table 4.
Aminobromination of β, β-dicyanostyrene derivatives reacted with ethylurethanm and NBS
表 4
β, β-二氰基苯乙烯衍生物与乌来糖、NBS的氨溴加成a
Table 4.
Aminobromination of β, β-dicyanostyrene derivatives reacted with ethylurethanm and NBS

Entry 1 R Product 4 T/h Yieldb/% 1 1a H 4ag 1 65 2 1b 4-CH3 4bg 2 75 3 1c 3-CH3 4cg 2.5 55 4 1d 4-OCH3 4dg 2.5 60 5 1e 3-OCH3 4eg 3 70 6 1f 3, 5-(OCH3)2 4fg 3 60 7 1g 2-CHCHCHCH-3 4gg 4 65 8 1h 3, 4, 5-(OCH3)3 4hg 2 60 9 1i 4-F 4ig 1 35 10 1j 4-Cl 4jg 0.5 45 11 1k 4-Br 4kg 0.5 50 12 1l 4-NO2 4lg 24 NR 13 1m 4-N(CH3)2 4mg 24 NP aReaction conditions: the β, β-dicyanostyrene Derivatives 1 (1 mmol), ethylurethanm 2g (2 mmol), NBS 3 (2 mmol), K2CO3 (50 mol%), CH2Cl2 (10 mL), room temperature; bIsolated yield after column chromatographic separation; NR: no reaction; NP: no product was observed. 1.6 可能的反应机理
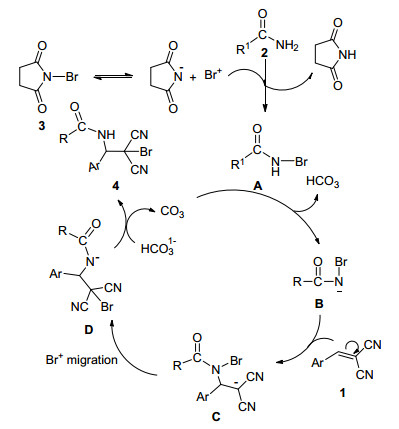
根据1f与丙烯酰胺和NBS反应中观察到的结果, 即实验中除了得到正常的加成产物以外(4fa), 同时还得到了苯环上溴代的产物(4fa*)这一事实, 说明反应中存在Br+ .我们认为这个Br+ 来源于NBS.另外所有产物均具有高度的区域选择性, 即氨基均加在了底物的苄基位, 而溴原子均加在了与氰基相连的碳原子上.通过以上反应情况, 本研究提出了可能的反应机理, 即亲核加成机理(Scheme 3).首先, NBS (3)发生异裂, 生成丁二酰亚氨负离子与Br+ .接着Br+ 与酰胺(2)发生氢溴交换反应形成N-溴代酰胺(A)及丁二酰亚胺(薄层色谱已检测到).在碱的作用下, A失去一个氢得到一个新的负离子B, 这一步已被文献[33]所证实.负离子B与β, β-二氰基苯乙烯(1)发生亲核加成反应得到C, 后者发生溴正离子迁移得到一个新的负离子D, D与HCO3-反应接受一个氢得到产物4, 而K2CO3催化下一个反应而循环使用.这个机理与文献[39, 42]报道相似.
2 结论
本文建立了以K2CO3催化的β, β-二氰基苯乙烯衍生物与酰胺、NBS一锅法合成邻溴代胺的新方法.室温下(无需惰性气体保护), 在CH2Cl2中, 各种不同结构的β, β-二氰基苯乙烯衍生物与多种不同结构的酰胺及NBS均能一锅法顺利形成相应的邻溴代胺, 由于该方法不仅对β, β-二氰基苯乙烯衍生物具有广泛的适应性, 而且对于酰胺也有广泛的适应性, 因而能使产物中氨基结构的变化具有很大的灵活性.同时实验证明, 在三组分合成邻卤代胺的体系中, 除NBS外, NCS也可用作卤源.氢谱和碳谱证实, 在形成邻溴代胺的过程中, 所有产物中的氨基均加在了β, β-二氰基苯乙烯衍生物的α-位, 而溴原子均加在了底物的β-位, 体现了高度的区域选择性.该方法操作简单, 反应条件温和、催化剂易得、稳定, 价格低廉, 为合成邻卤代氨提供了一个有效途径.
3 实验部分
3.1 试剂与仪器
实验所用试剂均为分析纯, 使用前未经纯化处理; 丙烯酰胺、乙酰胺、异丁酰胺、戊酰胺、苯甲酰胺、对硝基苯甲酰胺、乌来糖、N-溴代丁二酰亚胺(NBS)、N-氯代丁二酰亚胺(NCS)和N-碘代丁二酰亚胺(NIS)均购自国药集团化学试剂有限公司.
AVANCE 400 MHz超导傅里叶数字化核磁共振仪(瑞士Bruker公司); GCMS-QP 2010 Ultra型质谱仪(日本岛津公司); BS224S型电子天平(德国赛多利斯基团); IKA HB10型旋转蒸发仪(艾卡仪器设备有限公司); XT5A型显微熔点测定仪(北京市科仪电光仪器厂, 温度未加校正).
3.2 实验方法
3.2.1 化合物1的合成
β, β-二氰基苯乙烯衍生物1的合成, 依照文献[43], 合成路线见Eq. 2.
3.2.2 化合物4aa~4ma, 4ab~4af, 7的通用合成方法
以产物4aa的合成过程为例:在25 mL圆底烧瓶中依次加入β, β-二氰基苯乙烯(1a) 0.154 g (1.0 mmol)、丙烯酰胺(2a) 0.106 g (1.5 mmol)、NBS (3) 0.267 g (1.5 mmol)、碳酸钾0.007 g (0.05 mmol)、CH2Cl2 10 mL.室温下搅拌, 薄层色谱(TLC)跟踪反应直到原料斑点消失(3.5 h).在反应液中加入乙酸乙酯15 mL, 依次以饱和食盐水(15 mL×3)和蒸馏水(15 mL×3)洗涤.有机相用无水硫酸钠干燥过夜, 过滤除去干燥剂, 减压蒸馏得粗产品.粗产物经柱分离得1-苯基-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4aa), 黄色油状物, 产率93%. 1H NMR (400 MHz, CDCl3) δ: 7.96 (d, J=12.0 Hz, 1H), 7.60 (s, 2H), 7.46 (t, J=8.0 Hz, 3H), 6.46~6.32 (m, 2H), 6.16 (d, J=12.0 Hz, 1H), 5.79 (d, J=12.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 171.8, 165.7, 132.2, 130.5, 129.9, 129.2, 129.2, 128.5, 111.2, 111.2, 59.10, 31.01; IR (KBr) ν: 3645, 3283, 3036, 2212, 1958, 1666, 1529, 1221, 978, 702 cm-1. HRMS-ESI calcd for C13H10BrN3ONa [M+Na]+ 325.9905, found 325.9910.
1-(4-甲基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ba):黄色油状物, 产率92%. 1H NMR (400 MHz, CDCl3) δ: 7.91 (d, J=8.0 Hz, 1H), 7.49 (d, J=8.0 Hz, 2H), 7.24 (d, J=8.0 Hz, 2H), 6.46~6.32 (m, 2H), 6.11 (d, J=12.0 Hz, 1H), 5.78 (dd, J=8.0, 4.0 Hz, 1H), 2.38 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 171.7, 165.7, 140.7, 129.8, 129.2, 129.2, 128.3, 111.3, 111.2, 58.94, 31.24, 21.22; IR (KBr) ν: 3666, 3285, 3034, 2212, 1915, 1666, 1514, 1410, 1225, 1043, 980, 804, 741 cm-1. HRMS-ESI calcd for C14H12BrN3ONa [M+Na]+ 340.0061, found 340.0055.
1-(3-甲基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ca):黄色油状物, 产率85%. 1H NMR (400 MHz, CDCl3) δ: 7.74 (d, J=12.0 Hz, 1H), 7.39~7.29 (m, 4H), 6.46~6.34 (m, 2H), 6.09 (d, J=8.0 Hz, 1H), 5.78 (d, J=8.0Hz, 1H), 2.38 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.6, 139.1, 132.1, 131.2, 129.8, 129.2, 129.1, 129.1, 125.2, 111.3, 111.2, 59.09, 30.99, 21.40; IR (KBr) ν: 3288, 2986, 2739, 2251, 1950, 1666, 1529, 1408, 1223, 1045, 980, 800, 731 cm-1. HRMS-ESI calcd for C14H12BrN3ONa [M+Na]+ 340.0061, found 340.0063.
1-(4-甲氧基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4da):黄色油状物, 产率50%. 1H NMR (400 MHz, CDCl3) δ: 7.98 (d, J=8.0 Hz, 1H), 7.52 (d, J=12.0 Hz, 2H), 6.92 (d, J=8.0 Hz, 2H), 6.44~6.31 (m, 2H), 6.09 (d, J=8.0 Hz, 1H), 5.78~5.75 (m, 1H), 3.80 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.7, 161.0, 129.8, 129.7, 129.2, 124.1, 114.5, 111.3, 111.3, 58.73, 55.33, 31.40; IR (KBr) ν: 3632, 3285, 2963, 2841, 2363, 2251, 1666, 1512, 1408, 1184, 1032, 837 cm-1. HRMS-ESI calcd for C14H12-BrN3O2Na [M+Na]+ 356.0011, found 356.0007.
1-(3-甲氧基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ea):黄色油状物, 产率87%. 1H NMR (400 MHz, CDCl3) δ: 7.86 (d, J=12.0 Hz, 1H), 7.36 (t, J=8.0 Hz, 1H), 7.18 (d, J=4.0 Hz, 2H), 7.00 (d, J=4.0 Hz, 1H), 6.46~6.30 (m, 2H), 6.13 (d, J=12.0 Hz, 1H), 5.78 (t, J=8.0 Hz, 1H), 3.80 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.7, 159.9, 133.6, 130.3, 129.9, 129.1, 120.4, 115.8, 114.4, 111.3, 111.2, 59.08, 55.37, 30.83; IR (KBr) ν: 3466, 3350, 2957, 2841, 2170, 1668, 1599, 1410, 1261, 1043, 978, 879, 698 cm-1. HRMS-ESI calcd for C14H12BrN3-O2Na [M+Na]+ 356.0011, found 356.0007.
1-(3, 5-二甲氧基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4fa):黄色油状物, 产率40%. 1H NMR (400 MHz, CDCl3) δ: 6.68 (d, J=4.0 Hz, 3H), 6.55 (s, 1H), 6.49~6.45 (m, 1H), 6.25 (q, J=8.0 Hz, 1H), 5.98 (d, J=8.0 Hz, 1H), 5.85 (d, J=12.0 Hz, 1H), 3.83 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 164.9, 161.3, 134.3, 129.9, 129.0, 111.2, 111.0, 106.2, 105.3, 102.0, 59.08, 55.51, 30.52; IR (KBr) ν: 3292, 2926, 2228, 1672, 1597, 1462, 1300, 1207, 1065, 972, 843, 700 cm-1. HRMS-ESI calcd for C15H14BrN3O3Na [M+Na]+ 386.0116, found 386.0113.
1-(4-溴-3, 5-二甲氧基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4fa*):黄色油状物, 产率46%. 1H NMR (400 MHz, CDCl3) δ: 7.20 (d, J=8.0 Hz, 1H), 6.95~6.89 (m, 2H), 6.56 (s, 1H), 6.43 (d, J=16.0 Hz, 1H), 6.25 (q, J=8.0 Hz, 1H), 5.79 (d, J=12.0 Hz, 1H), 3.89 (s, 3H), 3.82 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 165.2, 160.4, 157.4, 134.3, 130.1, 128.9, 111.4, 110.8, 106.3, 104.4, 100.8, 57.16, 56.49, 55.76, 29.33; IR (KBr) ν: 3292, 2939, 2228, 1672, 1591, 1460, 1319, 1205, 1067, 978, 843, 648 cm-1.
1-(α-萘基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ga):黄色油状物, 产率91%. 1H NMR (400 MHz, CDCl3) δ: 8.07 (s, 1H), 7.97 (d, J=8.0 Hz, 1H), 7.85 (dd, J=8.0, 8.0 Hz, 3H), 7.67 (dd, J=4.0, 4.0 Hz, 1H), 7.54 (q, J=8.0 Hz, 2H), 6.49~6.32 (m, 3H), 5.7 (t, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 171.6, 165.7, 133.8, 132.7, 129.2, 128.8, 128.4, 127.8, 127.6, 127.1, 124.6, 111.3, 111.2, 59.31, 30.96; IR (KBr) ν: 3285, 3057, 2932, 2359, 1934, 1666, 1529, 1408, 1221, 1045, 978, 820, 752 cm-1. HRMS-ESI calcd for C17H12BrN3ONa [M+Na]+ 376.0061, found 376.0063.
1-(3, 4, 5-三甲氧基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ha):黄色油状物, 产率35%. 1H NMR (400 MHz, CDCl3) δ: 7.05 (d, J=12.0 Hz, 1H), 6.78 (s, 2H), 6.46 (d, J=16.0 Hz, 1H), 6.27 (q, J=8.0 Hz, 1H), 6.03 (d, J=8.0, 1H), 5.84 (d, J=12.0 Hz, 1H), 3.87 (s, 9H); 13C NMR (100 MHz, CDCl3) δ: 165.1, 153.7, 139.7, 130.1, 128.9, 127.5, 111.4, 111.1, 105.4, 60.87, 59.38, 56.30, 30.58; IR (KBr) ν: 3639, 3281, 2943, 2843, 2212, 1711, 1593, 1506, 1331, 1126, 995 cm-1. HRMS-ESI calcd for C16H16BrN3O4Na [M+Na]+ 416.0222, found 416.0219.
1-(4-氟苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ia):黄色油状物, 产率80%. 1H NMR (400 MHz, CDCl3) δ: 7.85 (d, J=12.0 Hz, 1H), 7.61 (q, J=4.0 Hz, 2H), 7.15 (d, J=8.0 Hz, 2H), 6.45~6.29 (m, 2H), 6.16 (d, J=8.0 Hz, 1H), 5.81 (t, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.6, 163.7 (JC-F=250.0 Hz), 130.5 (JC-F=8.0 Hz), 130.1, 129.0, 128.1 (JC-F=3.0 Hz), 116.3 (JC-F=22.0 Hz), 111.1, 111.0, 58.39, 30.88; IR (KBr) ν: 3657, 3281, 3034, 2212, 1668, 1512, 1410, 1225, 1080, 978, 845, 744 cm-1. HRMS-ESI calcd for C13H9BrFN3-ONa [M+Na]+ 343.9811, found 343.9806.
1-(4-氯苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ja):黄色油状物, 产率85%. 1H NMR (400 MHz, CDCl3) δ: 7.81 (d, J=8.0 Hz, 1H), 7.54 (d, J=8.0 Hz, 2H), 7.42 (d, J=8.0 Hz, 2H), 6.45(d, J=8.0 Hz, 1H), 6.32 (q, J=8.0 Hz, 1H), 6.15 (d, J=12.0 Hz, 1H), 5.82 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.6, 136.8, 130.6, 130.2, 129.8, 129.5, 128.9, 111.0, 111.0, 58.44, 30.63; IR (KBr) ν: 3288, 2986, 2355, 2212, 1911, 1666, 1630, 1529, 1410, 1219, 1094, 980, 839, 750 cm-1. HRMS-ESI calcd for C13H9BrClN3ONa [M+Na]+ 359.9515, found 359.9511.
1-(4-溴苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4ka):黄色油状物, 产率80%. 1H NMR (400 MHz, CDCl3) δ: 7.96 (d, J=8.0 Hz, 1H), 7.57 (d, J=8.0 Hz, 2H), 7.47 (d, J=8.0 Hz, 2H), 6.45~6.29 (m, 2H), 6.13 (d, J=8.0 Hz, 1H), 5.81 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.7, 132.4, 131.1, 130.2, 130.1, 128.9, 125.0, 111.0, 111.0, 58.52, 30.52; IR (KBr) ν: 3290, 2984, 2361, 2214, 1913, 1668, 1529, 1219, 1074, 978, 837, 746 cm-1. HRMS-ESI calcd for C13H9Br2N3ONa [M+Na]+ 405.8990, found 405.8989.
1-(4-硝基苯基)-2, 2-二氰基-1-丙烯酰氨基-2-溴乙烷(4la):黄色油状物, 产率87%. 1H NMR (400 MHz, CDCl3) δ: 8.32 (d, J=8.0 Hz, 2H), 7.80 (d, J=8.0 Hz, 2H), 7.21 (d, J=8.0 Hz, 1H), 6.46 (d, J=16.0 Hz, 1H), 6.34~6.24 (m, 2H), 5.87 (d, J=12.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.1, 149.1, 138.8, 130.2, 129.6, 128.7, 124.2, 110.6, 110.6, 58.32, 29.80; IR (KBr) ν: 3612, 3327, 2926, 2228, 1709, 1524, 1350, 1180, 982, 860, 638 cm-1. HRMS-ESI calcd for C13H9BrN4O3Na [M+Na]+ 370.9756, found 370.9755.
1-苯基-2, 2-二氰基-1-乙酰氨基-2-溴乙烷(4ab):白色固体, 产率99%. m.p. 158.0~159.5 ℃(文献值[36]: m.p. 158.0~159.5 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.40 (s, 5H), 5.30 (s, 1H), 4.71 (d, J=4.0 Hz, 1H), 1.98 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 171.3, 133.6, 130.3, 129.6, 127.2, 111.4, 111.0, 54.0, 29.11, 22.90.
1-苯基-2, 2-二氰基-1-戊酰氨基-2-溴乙烷(4ac):黄色油状物, 产率82%. 1H NMR (400 MHz, CDCl3) δ: 7.72 (d, J=12.0 Hz, 1H), 7.57 (d, J=8.0 Hz, 2H), 7.44 (q, J=8.0 Hz, 3H), 6.08 (d, J=8.0 Hz, 1H), 2.33 (q, J=8.0 Hz, 2H), 1.63 (q, J=8.0 Hz, 2H), 1.33 (t, J=8.0 Hz, 2H), 0.87 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 173.9, 132.3, 130.5, 129.2, 128.5, 111.4, 111.3, 58.69, 36.03, 31.29, 27.67, 22.33, 13.79; IR (KBr) ν: 3649, 3292, 2961, 2249, 1892, 1663, 1528, 1375, 1256, 1045, 847, 704 cm-1. HRMS-ESI calcd for C15H16BrN3ONa [M+Na]+ 356.0374, found 356.0362.
1-苯基-2, 2-二氰基-1-异丁酰氨基-2-溴乙烷(4ad):白色固体, 产率66%. m.p. 110.0~112.5 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 9.18 (d, J=8.0 Hz, 1H), 7.74 (d, J=4.0 Hz, 2H), 7.47 (s, 3H), 6.06 (d, J=8.0 Hz, 1H), 2.71 (t, J=8.0 Hz, 1H), 1.13 (d, J=8.0 Hz, 3H), 0.97 (d, J=4.0 Hz, 3H); 13C NMR (100 MHz, DMSO) δ: 176.5, 133.3, 129.6, 128.9, 128.5, 127.3, 112.2, 112.1, 56.89, 33.45, 30.83, 19.97, 18.70; IR (KBr) ν: 3329, 2972, 2249, 1668, 1524, 1375, 1211, 1103, 949, 714, 619 cm-1. HRMS-ESI calcd for C14H14BrN3ONa [M+Na]+ 342.0218, found 342.0214.
1-苯基-2, 2-二氰基-1-苯甲酰氨基-2-溴乙烷(4ae):黄色油状物, 产率81%. 1H NMR (400 MHz, CDCl3) δ: 7.76 (d, J=8.0 Hz, 2H), 7.51 (d, J=4.0 Hz, 3H), 7.43 (d, J=4.0 Hz, 5H), 6.90 (d, J=8.0 Hz, 1H), 6.11 (d, J=12.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.9, 131.8, 131.7, 131.3, 129.7, 128.4, 128.0, 127.0, 126.3, 110.1, 110.0, 58.17, 30.14; IR (KBr) ν: 3649, 3285, 3065, 2249, 1963, 1653, 1520, 1258, 1045, 714 cm-1. HRMS-ESI calcd for C17H12BrN3ONa [M+Na]+ 376.0061, found 376.0050.
1-苯基-2, 2-二氰基-1-(4-硝基苯甲酰氨基)-2-溴乙烷(4af):黄色油状物, 产率50%. 1H NMR (400 MHz, CDCl3) δ: 8.02 (d, J=8.0 Hz, 2H), 7.86 (d, J=12.0 Hz, 1H), 7.78 (d, J=8.0 Hz, 2H), 7.56 (d, J=8.0 Hz, 2H), 7.40 (t, J=8.0 Hz, 3H), 6.14 (d, J=8.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 166.2, 149.9, 138.4, 131.8, 130.9, 129.5, 128.9, 128.4, 123.8, 111.2, 111.1, 59.53, 30.83; IR (KBr) ν: 3362, 3061, 2928, 2257, 1963, 1672, 1526, 1348, 1051, 866, 700 cm-1. HRMS-ESI calcd for C17H11BrN4O3Na [M+Na]+ 420.9912, found 420.9907.
1-苯基-2, 2-二氰基-1-丙烯酰氨基-2-氯乙烷(7):淡黄色油状物, 产率86%. 1H NMR (400 MHz, CDCl3) δ: 7.55 (d, J=8.0 Hz, 1H), 7.49 (d, J=8.0 Hz, 2H), 7.37 (t, J=8.0 Hz, 3H), 6.33 (d, J=20.0 Hz, 1H), 6.24 (d, J=12.0 Hz, 1H), 6.09 (d, J=12.0 Hz, 1H), 5.69 (d, J=12.0 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.60, 131.67, 130.60, 129.89, 129.27, 129.15, 128.54, 111.00, 110.93, 59.52, 48.64; IR (KBr) ν: 3653, 3292, 2945, 2255, 1962, 1718, 1528, 1360, 1213, 980, 804, 700 cm-1. HRMS-ESI calcd for C13H10ClN3ONa [M+Na]+ 282.0410, found 282.0413.
3.2.3 化合物4ag~4kg的通用合成方法
当以乌来糖替代其它酰胺时, 除了乌来糖和NBS的量为底物的2倍、催化剂为底物的50 mol%以及反应时间用平行实验比较收率确定之外, 其它反应步骤均与上相同.
1-苯基-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4ag):淡黄色油状物, 收率65%. 1H NMR (400 MHz, CDCl3) δ: 7.55 (dt, J=4.0, 8.0 Hz, 5H), 5.81 (s, 1H), 5.64 (d, J=8.0 Hz, 1H), 4.26 (q, J=4.0 Hz, 2H), 1.31 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 132.3, 130.5, 129.2, 127.9, 111.0, 111.0, 62.54, 61.61, 31.57, 14.31; IR (KBr) ν: 3308, 2984, 2226, 1703, 1529, 1373, 1244, 1043, 1043, 893, 775, 704, 627 cm-1. HRMS-ESI calcd for C13H12Br-N3O2Na [M+Na]+ 344.0011, found 344.0014.
1-(4-甲基苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4bg):黄色油状物, 产率75%. 1H NMR (400 MHz, CDCl3) δ: 7.41 (d, J=8.0 Hz, 2H), 7.28 (d, J=8.0 Hz, 2H), 6.01 (s, 1H), 5.63 (d, J=8.0 Hz, 1H), 4.24 (dd, J=8.0, 4.0 Hz, 2H), 2.40 (s, 3H), 1.29 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.4, 140.7, 129.8, 129.4, 127.9, 111.1, 62.44, 61.46, 31.84, 21.19, 14.33; IR (KBr) ν: 3308, 2984, 2737, 2226, 1915, 1705, 1580, 1512, 1373, 1242, 1043, 810 cm-1. HRMS-ESI calcd for C14H14BrN3-O2Na [M+Na]+ 358.0167, found 358.0170.
1-(3-甲基苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4cg):黄色油状物, 产率55%. 1H NMR (400 MHz, CDCl3) δ: 7.33 (dt, J=8.0, 8.0 Hz, 4H), 6.04 (d, J=4.0 Hz, 1H), 5.63 (d, J=8.0 Hz, 1H), 4.24 (dd, J=12, 4.0 Hz, 2H), 2.41 (s, 3H), 1.29 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.4, 139.1, 132.3, 131.2, 129.1, 128.7, 125.0, 111.1, 62.45, 61.60, 31.66, 21.40, 14.34; IR (KBr) ν: 3653, 3306, 2984, 2226, 1709, 1529, 1373, 1244, 1097, 1043, 933, 876, 777, 710 cm-1. HRMS-ESI calcd for C14H14Br-N3O2Na [M+Na]+ 358.0167, found 358.0172.
1-(4-甲氧基苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4dg):黄色油状物, 产率60%. 1H NMR (400 MHz, CDCl3) δ: 7.46 (d, J=8.0 Hz, 2H), 6.96 (d, J=8.0 Hz, 2H), 6.21 (s, 1H), 5.63 (s, 1H), 4.22 (dd, J=4.0, 8.0 Hz, 2H), 3.83 (s, 3H), 1.27 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 161.0, 155.5, 132.1, 131.7, 129.4, 124.3, 114.5, 111.2, 62.42, 61.24, 55.35, 32.06, 14.33; IR (KBr) ν: 3626, 3302, 2980, 2841, 2226, 2039, 1715, 1512, 1256, 1182, 1030, 835 cm-1. HRMS-ESI calcd for C14H14Br-N3O3Na [M+Na]+ 374.0116, found 374.0117.
1-(3-甲氧基苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4eg):黄色油状物, 产率70%. 1H NMR (400 MHz, CDCl3) δ: 7.37 (t, J=8.0 Hz, 1H), 7.10 (d, J=8.0 Hz, 2H), 7.02 (s, 1H), 6.22 (d, J=4.0 Hz, 1H), 5.66 (d, J=8.0 Hz, 1H), 4.23 (q, J=8.0 Hz, 2H), 3.83 (s, 3H), 1.28 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 159.9, 155.6, 133.7, 130.3, 120.2, 115.9, 113.9, 111.2, 62.47, 61.64, 55.38, 31.52, 14.33; IR (KBr) ν: 3665, 3298, 2978, 2226, 1709, 1528, 1252, 1043, 781 cm-1. HRMS-ESI calcd for C14H14BrN3O3Na [M+Na]+ 374.0116, found 374.0122.
1-(3, 5-二甲氧基苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4fg):黄色油状物, 产率60%. 1H NMR (400 MHz, CDCl3) δ: 6.63 (s, 2H), 6.55 (d, J=4.0 Hz, 1H), 5.77 (d, J=4.0 Hz, 1H), 5.54 (d, J=8.0 Hz, 1H), 4.24 (q, J=8.0 Hz, 2H), 3.83 (s, 6H), 1.30 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 161.2, 155.2, 134.3, 111.2, 111.1, 106.1, 102.1, 62.52, 61.78, 55.50, 31.24, 14.32; IR (KBr) ν: 3665, 3298, 2939, 2228, 1713, 1597, 1464, 1300, 1205, 1161, 1042, 845, 723 cm-1. HRMS-ESI calcd for C15H16BrN3O4Na [M+Na]+ 404.0222, found 404.0228.
1-(α-萘基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4gg):黄色油状物, 产率65%. 1H NMR (400 MHz, CDCl3) δ: 8.02 (s, 1H), 7.91 (td, J=8.0, 8.0 Hz, 3H), 7.60 (t, J=8.0 Hz, 3H), 6.21 (s, 1H), 5.89 (d, J=8.0 Hz, 1H), 4.27 (q, J=8.0 Hz, 2H), 1.31 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.5, 133.8, 132.7, 129.6, 129.3, 128.4, 127.8, 127.6, 127.2, 124.3, 111.2, 111.2, 62.59, 61.81, 31.64, 14.37; IR (KBr) ν: 3302, 2984, 2934, 2224, 1931, 1703, 1533, 1250, 1045, 822, 752 cm-1. HRMS-ESI calcd for C17H14BrN3O2Na [M+Na]+ 394.0167, found 394.0172.
1-(3, 4, 5-三甲氧基苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4hg):黄色油状物, 产率60%. 1H NMR (400 MHz, CDCl3) δ: 6.72 (s, 2H), 5.90 (d, J=4.0 Hz, 1H), 5.55 (d, J=8.0 Hz, 1H), 4.24 (q, J=8.0 Hz, 2H), 3.90 (s, 6H), 3.88 (s, 3H), 1.31 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.3, 153.6, 139.7, 127.6, 111.2, 111.2, 105.24, 62.55, 62.11, 60.86, 56.30, 14.33; IR (KBr) ν: 3352, 3190, 2984, 2841, 2226, 1715, 1593, 1464, 1373, 1379, 1333, 1236, 1126, 847, 787 cm-1. HRMS-ESI calcd for C16H18BrN3O5Na [M+Na]+ 434.0328, found 434.0310.
1-(4-氟苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4ig):黄色油状物, 产率35%. 1H NMR (400 MHz, CDCl3) δ: 7.54 (q, J=4.0 Hz, 2H), 7.17 (t, J=8.0 Hz, 2H), 6.04 (d, J=4.0 Hz, 1H), 5.70 (d, J=8.0 Hz, 1H), 4.25 (dd, J=8.0, 4.0 Hz, 2H), 1.30 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 163.7 (JC-F=250.0 Hz), 155.3, 130.1 (JC-F=8.0 Hz), 128.3 (JC-F=4.0 Hz), 116.3 (JC-F=22.0 Hz), 116.2, 111.0, 62.64, 60.88, 31.58, 14.30; IR (KBr) ν: 3653, 3306, 2986, 2228, 1904, 1709, 1605, 1510, 1373, 1232, 1165, 1043, 843, 775 cm-1. HRMS-ESI calcd for C13H11BrFN3O2Na [M+Na]+ 361.9916, found 361.9920.
1-(4-氯苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4jg):黄色油状物, 产率45%. 1H NMR (400 MHz, CDCl3) δ: 7.48 (t, J=12.0 Hz, 2H), 7.43 (s, 2H), 6.28 (s, 1H), 5.73 (d, J=4.0 Hz, 1H), 4.25 (dd, J=8.0, 4.0 Hz, 2H), 1.28 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.4, 136.7, 131.0, 130.8, 129.5, 129.4, 111.0, 62.66, 60.88, 31.40, 14.32; IR (KBr) ν: 3649, 3308, 2984, 2606, 2228, 1913, 1715, 1583, 1531, 1373, 1244, 1043, 839, 775 cm-1. HRMS-ESI calcd for C13H11BrClN3O2Na [M+Na]+ 377.9621, found 377.9624.
1-(4-溴苯基)-2, 2-二氰基-1-乙氧甲酰氨基-2-溴乙烷(4kg):黄色油状物, 产率50%. 1H NMR (400 MHz, CDCl3) δ: 7.61 (d, J=12.0 Hz, 2H), 7.42 (d, J=8.0 Hz, 2H), 6.19 (d, J=4.0 Hz, 1H), 5.71 (s, 1H), 4.24 (dd, J=4.0, 8.0 Hz, 2H), 1.29 (t, J=8.0 Hz, 3H); 13C NMR (100 MHz, CDCl3) δ: 155.4, 132.4, 131.3, 129.7, 125.0, 110.9, 62.70, 60.94, 31.27, 14.34; IR (KBr) ν: 3649, 3308, 2984, 2228, 1913, 1728, 1583, 1531, 1373, 1244, 1043, 887, 835, 775 cm-1. HRMS-ESI calcd for C13H11Br2N3O2Na [M+Na]+ 423.9095, found 423.9099.
辅助材料(Supporting Information) 4aa~4ma, 4ab~4af, 7, 4ag~4kg的1H NMR、13C NMR和HRMS图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Chanda, B. M.; Vyas, R.; Landge, S. S. J. Mol. Catal. A:Chem. 2004, 223, 57. doi: 10.1016/j.molcata.2003.09.039
-
[2]
Thakur, V. V.; Sudalai, A. Tetrahedron Lett. 2003, 44, 989. doi: 10.1016/S0040-4039(02)02729-6
-
[3]
Han, J.-L.; Li, Y.-F.; Zhi, S.-J.; Pan, Y.; Timmonsc, C.; Li, G.-G. Tetrahedron Lett. 2006, 47, 7225. doi: 10.1016/j.tetlet.2006.07.143
-
[4]
Chanda, B. M.; Vyas, R.; Bedekar, A. V. J. Org. Chem. 2001, 66, 30. doi: 10.1021/jo000013v
-
[5]
Ghorai, M. K.; Das, K.; Shukla, D. J. Org. Chem. 2007, 72, 5859. doi: 10.1021/jo0703294
-
[6]
D'hooghe, M.; Speybroeck, V. V.; Nieuwenhove, A. V.; Waro-quier, M.; Kimpe, N. D. J. Org. Chem. 2007, 72, 4733. doi: 10.1021/jo0704210
-
[7]
Savoia, D.; Alvaro, G.; Fabio, R. D.; Gualandi, A. J. Org. Chem. 2007, 72, 3859. doi: 10.1021/jo070364a
-
[8]
Wei, H.-X.; Siruta, S.; Li, G.-G. Tetrahedron Lett. 2002, 43, 3809. doi: 10.1016/S0040-4039(02)00694-9
-
[9]
Wolfe, J. P.; Ney, J. E. Org. Lett. 2003, 5, 4607. doi: 10.1021/ol0357651
-
[10]
Li, M.-R.; Yuan, H.-Y.; Zhao, B.-Z.; Liang, F.-S.; Zhang, J.-P. Chem. Commun. 2014, 50, 2360. doi: 10.1039/c3cc49572h
-
[11]
Chen, D.-J.; Guo, L.; Liu, J.-Y.; Kirtane, S.; Cannon, J. F.; Li, G.-G. Org. Lett. 2005, 7, 921. doi: 10.1021/ol050002u
-
[12]
Chen, Z.-G.; Du, M.-F.; Xia, W.; Hu, J.-L. Chem. Res. Chin. Univ. 2016, 32, 68. doi: 10.1007/s40242-016-5233-4
-
[13]
陈战国, 王英杰, 刘德娥, 刘亚丽, 李亚男, 王丹, 葛淼, 高等学校化学学报, 2014, 35, 1458. doi: 10.7503/cjcu20131129Chen, Z.-G.; Wang, Y.-J.; Liu, D.-E.; Liu, Y.-L.; LI, Y.-N.; Wang, D.; Ge, M. Chem. J. Chin. Univ. 2014, 35, 1458(in Chinese). doi: 10.7503/cjcu20131129
-
[14]
闻化, 王英杰, 刘德娥, 刘亚丽, 葛淼, 陈战国, 有机化学, 2014, 34, 916. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344251.shtmlWen, H.; Wang, Y.-J.; Liu, D.-E.; Liu, Y.-L.; Ge, M.; Chen, Z.-G. Chin. J. Org. Chem. 2014, 34, 916(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344251.shtml
-
[15]
陈战国, 刘德娥, 李文丽, 刘亚丽, 高等学校化学学报, 2014, 35, 2360. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Chen, Z.-G.; Liu, D.-E.; Li, W.-L.; Liu, Y.-L. Chem. J. Chin. Univ. 2014, 35, 2360(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[16]
陈战国, 王丹, 李亚男, 王英杰, 胡均利, 夏伟, 化学学报, 2012, 70, 2236. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Chen, Z.-G.; Wang, D.; Li, Y.-N.; Wang, Y.-J.; Hu, J.-L.; Xia, W. Acta Chim. Sinica 2012, 70, 2236(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[17]
Kharasch, M. S.; Priestley, H. N. J. Am. Chem. Soc. 1939, 61, 3425. doi: 10.1021/ja01267a057
-
[18]
Li, G.-G.; Saibau Kotti, S. R. S.; Cody, T. Eur. J. Org. Chem. 2007, 17, 2745.
-
[19]
Thakur, V. V.; Talluri, S. K.; Sudalai, A. Org. Lett. 2003, 5, 861. doi: 10.1021/ol027530f
-
[20]
Wei, H.-X.; Kim, S. H.; Li, G.-G. Tetrahedron 2001, 57, 3869. doi: 10.1016/S0040-4020(01)00228-9
-
[21]
Chen, Z.-G.; Wei, J.-F., Li, R.-T.; Shi, X.-Y.; Zhao, P.-F. J. Org. Chem. 2009, 74, 1371. doi: 10.1021/jo8023768
-
[22]
Wu, X.-L.; Wang, G.-W. J. Org. Chem. 2007, 72, 9398. doi: 10.1021/jo701957t
-
[23]
Wu, X.-L.; Xia, J.-J.; Wang G.-W. Org. Biomol. Chem. 2008, 6, 548. doi: 10.1039/B717333D
-
[24]
Liu, J.-Y.; Wang, Y.-N.; Li, G.-G. Eur. J. Org. Chem. 2006, 14, 3112.
-
[25]
Timmons, C.; Chen, D.-J.; Xu, X.; Li, G.-G. Eur. J. Org. Chem. 2003, 19, 3850.
-
[26]
Ma, L.; Du, D.-M.; Xu, J.-X. J. Org. Chem. 2005, 70, 10155. doi: 10.1021/jo051765y
-
[27]
Li, G.-G.; Kim, S. H.; Wei, H.-X. Tetrahedron 2001, 57, 8407. doi: 10.1016/S0040-4020(01)00847-X
-
[28]
Li, G.-G.; Kim, S. H.; Wei, H.-X. Org. Lett. 2000, 2, 2249. doi: 10.1021/ol000120b
-
[29]
Li, G.-G.; Kim, S. H.; Wei, H.-X. Tetrahedron Lett. 2000, 41, 8699. doi: 10.1016/S0040-4039(00)01579-3
-
[30]
Zhi, S.; Han, J.; Lin, C.; An, G.; Pan, Y.; Li, G.-G. Synthesis 2008, 1570. doi: 10.1002/chin.200841072/full
-
[31]
Kotti, S. R. S. S.; Xu, X.; Wang, Y.-N.; Headley, A. D.; Li, G.-G. Tetrahedron Lett. 2004, 45, 7209. doi: 10.1016/j.tetlet.2004.08.040
-
[32]
Chen, Z.-G.; Zhao, P.-F.; Wang, Y. Eur. J. Org. Chem. 2011, 5887.
-
[33]
Chen, Z.-G.; Wang, Y.; Wei, J.-F.; Zhao, P.-F.; Shi, X.-Y. J. Org. Chem. 2010, 75, 2085. doi: 10.1021/jo9026879
-
[34]
Wang, Y.-N.; Ni, B.; Headley, A. D.; Li, G.-G. Adv. Synth. Catal. 2007, 349, 319. doi: 10.1002/(ISSN)1615-4169
-
[35]
Phukan, P.; Chakraborty, P.; Kataki, D. J. Org. Chem. 2006, 71, 7533. doi: 10.1021/jo0600611
-
[36]
Chen, Z.-G.; Li, Y.-N.; Zhou, J.-M.; Wang, D.; Ge, M. Chem. Res. Chin. Univ. 2014, 30(2), 266. doi: 10.1007/s40242-014-3234-8
-
[37]
Chen, Z.-G.; Xia, W.; Liu, D.-E.; Liu, Y.-L.; Du, M.-F.; Cao, C.-X. J. Chin. Chem. Soc. 2016, 63, 158. doi: 10.1002/jccs.v63.2
-
[38]
Li, W.-L.; Chen, Z.-G.; Zhou, J.-M.; Hu, J.-L.; Xia, W. Chin. J. Chem. 2012, 30, 830. doi: 10.1002/cjoc.201100346
-
[39]
杜曼飞, 侯丹, 惠文萍, 陈战国, 高等学校化学学报, 2016, 37, 902. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Du, M.-F.; Hou, D.; Hui, W.-P.; Chen, Z.-G. Chem. J. Chin. Univ. 2016, 37, 902(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[40]
陈战国, 侯丹, 刘德娥, 惠文萍, 有机化学, 2016, 36, 2191. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345545.shtmlChen, Z.-G.; Hou, D.; Liu, D.-E.; Hui, W.-P. Chin. J. Org. Chem. 2016, 36, 2191(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345545.shtml
-
[41]
Soliman, H. A.; Khatab, T. K.; Abdel-Megeid, F. M. E. Chin. Chem. Lett. 2016, 27, 1515. doi: 10.1016/j.cclet.2016.03.026
-
[42]
陈战国, 周继梅, 王芸, 李文丽, 化学学报, 2011, 69, 2851. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Chen, Z.-G.; Zhou, J.-M.; Wang, Y.; Li, W.-L. Acta Chim. Sinica 2011, 69, 2851(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[43]
屠树江, 荣良策, 高原, 郭苏闵, 鲁水华, 杨晓洁, 有机化学, 2002, 22, 364. doi: 10.3321/j.issn:0253-2786.2002.05.011Tu, S. J.; Rong, L. C.; Gao, Y.; Guo, S. M.; Lu, S. H.; Yang, X. J. Chin. J. Org. Chem. 2002, 22, 364(in Chinese). doi: 10.3321/j.issn:0253-2786.2002.05.011
-
[1]
-
表 1 溶剂、物料比、碱及其用量对β, β-二氰基苯乙烯与丙烯酰胺、NBS的氨溴加成反应的影响a
Table 1. Effect of solvent, the ratio of starting materials, base as well as its loading to the aminobromination of β, β-dicyanostyrene with acrylamide and NBS

Entry Solvent Base (mol%) Ratio t/h Yieldb/% 1 DMF Na2CO3 (110) 1:2:2 24 NP 2 CH3OH Na2CO3 (110) 1:2:2 24 NP 3 CH3CN Na2CO3 (110) 1:2:2 0.33 42 4 Acetone Na2CO3 (110) 1:2:2 0.33 60 5 THF Na2CO3 (110) 1:2:2 0.33 84 6 CHCl3 Na2CO3 (110) 1:2:2 5 90 7 CH2Cl2 Na2CO3 (110) 1:2:2 3 95 8 CH2Cl2 Na2CO3 (110) 1:1.1:1.1 4 82 9 CH2Cl2 Na2CO3 (110) 1:1.5:1.5 3 91 10 CH2Cl2 KOH (110) 1:1.5:1.5 2 72 11 CH2Cl2 NaOH (110) 1:1.5:1.5 2 77 12 CH2Cl2 K3PO4 (110) 1:1.5:1.5 1.5 55 13 CH2Cl2 NaOAc (110) 1:1.5:1.5 2 85 14 CH2Cl2 K2CO3 (110) 1:1.5:1.5 1.5 91 15 CH2Cl2 K2CO3(50) 1:1.5:1.5 1.5 92 16 CH2Cl2 K2CO3(10) 1:1.5:1.5 1.5 92 17 CH2Cl2 K2CO3(5) 1:1.5:1.5 3.5 93 18 CH2Cl2 K2CO3(2) 1:1.5:1.5 10 93 19 CH2Cl2 - 1:1.5:1.5 24 22 aReaction conditions: substrate (1.0 mmol), acrylamide (1.1~2 mmol), NBS (1.1~2 mmol), base (2~110 mol%), solvent (10 mL), room temperature; bIsolated yield after column chromatographic separation; NP: no product was observed. 表 2 β, β-二氰基苯乙烯衍生物与丙烯酰胺、NBS的氨溴加成反应a
Table 2. K2CO3-catalyzed aminobromination of β, β-dicyano-styrene derivatives reacted with acrylamide and NBS

Entry 1 Ar Product 4 T/h Yieldb/% 1 1a C6H5 4aa 3.5 93 2 1b 4-CH3C6H4 4ba 2.5 92 3 1c 3-CH3C6H4 4ca 4 85 4 1d 4-CH3OC6H4 4da 8 50 5 1e 3-CH3OC6H4 4ea 1.5 87 6 1f 3, 5-(CH3O)2C6H3 4fa, 4fa* 2 40c, 46d 7 1g 1-Naphthyl 4ga 24 91 8 1h 3, 4, 5-(CH3O)3C6H2 4ha 24 35 9 1i 4-FC6H4 4ia 0.5 80 10 1j 4-ClC6H4 4ja 0.7 85 11 1k 4-BrC6H4 4ka 0.5 80 12 1l 4-O2NC6H4 4la 2 87 13 1m 4-(CH3)2NC6H4 4ma 24 NP aReaction conditions: the β, β-dicyanostyrene derivatives (1 mmol), acrylamide (1.5 mmol), NBS (1.5 mmol), K2CO3 (5 mol%, molar fraction), CH2Cl2(10 mL), room temperature.; bIsolated yield after column chromatographic separation. cNormal addition product. dAddition product is a aromatic substituted products; NP: no product was observed. 表 3 β, β-二氰基苯乙烯1a与酰胺、NBS的氨溴加成反应a
Table 3. Aminobromination of β, β-dicyanostyrene 1a reacted with amides and NBS

Entry 1 Amide R1 Product 4 t/h Yieldb/% 1 1a 2b CH3 4ab 0.5 93 2 1a 2c CH2CH2CH2CH3 4ac 8 82 3 1a 2d CH(CH3)2 4ad 6 66 4 1a 2e C6H5 4ae 2 81 5 1a 2f 4-O2NC6H4 4af 18 50 aReaction conditions: the β, β-dicyanostyrene (1a) (1 mmol), amides 2b~2f (1.5 mmol), NBS 3 (1.5 mmol), K2CO3 (5 mol%, molar fraction), CH2Cl2(10 mL), room temperature; bIsolated yield after column chromatographic separation. 表 4 β, β-二氰基苯乙烯衍生物与乌来糖、NBS的氨溴加成a
Table 4. Aminobromination of β, β-dicyanostyrene derivatives reacted with ethylurethanm and NBS

Entry 1 R Product 4 T/h Yieldb/% 1 1a H 4ag 1 65 2 1b 4-CH3 4bg 2 75 3 1c 3-CH3 4cg 2.5 55 4 1d 4-OCH3 4dg 2.5 60 5 1e 3-OCH3 4eg 3 70 6 1f 3, 5-(OCH3)2 4fg 3 60 7 1g 2-CHCHCHCH-3 4gg 4 65 8 1h 3, 4, 5-(OCH3)3 4hg 2 60 9 1i 4-F 4ig 1 35 10 1j 4-Cl 4jg 0.5 45 11 1k 4-Br 4kg 0.5 50 12 1l 4-NO2 4lg 24 NR 13 1m 4-N(CH3)2 4mg 24 NP aReaction conditions: the β, β-dicyanostyrene Derivatives 1 (1 mmol), ethylurethanm 2g (2 mmol), NBS 3 (2 mmol), K2CO3 (50 mol%), CH2Cl2 (10 mL), room temperature; bIsolated yield after column chromatographic separation; NR: no reaction; NP: no product was observed. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 3418
- HTML全文浏览量: 257


 下载:
下载:


 下载:
下载:

