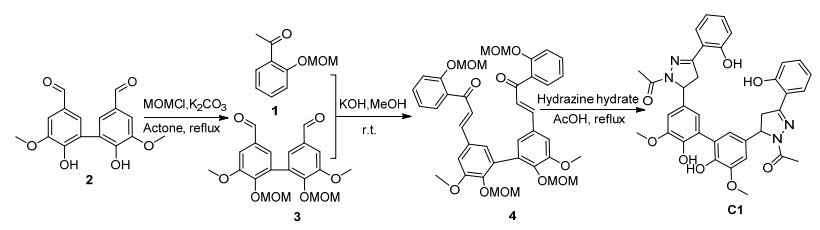
 图式 1
探针化合物C1合成路线
Scheme1.
Synthesis of fluorescent probe C1
图式 1
探针化合物C1合成路线
Scheme1.
Synthesis of fluorescent probe C1

Citation: Yang Yunshang, Cao Bixia, Zhang Yingpeng, Dong Yuying. Bispyrazoline Fluorescent Probe for the Recognition of Cu2+ and Zn2+ with Different Fluorescence[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 3024-3030. doi: 10.6023/cjoc201702024

通过不同荧光现象识别Cu2+和Zn2+的双吡唑啉荧光探针
English
Bispyrazoline Fluorescent Probe for the Recognition of Cu2+ and Zn2+ with Different Fluorescence
-
Key words:
- bispyrazoline
- / bifunctional
- / fluorescent probe
- / copper ion
- / zinc ion
-
所有生物体的生长发育过程都需要Cu2+、Na+、K+、Ca2+、Fe3+、Zn2+等各种金属离子的参与, 金属离子在生物体内各项生命活动中扮演着非常重要的角色, 体内金属离子浓度平衡的破坏非常危险, 可能导致各种疾病发生[1].在这些金属离子中, Cu2+和Zn2+因其显著的生物学作用受到广泛关注[2, 3].当生物体内Cu2+浓度超出或低于细胞所需浓度范围时就会扰乱生命系统的正常活动, 从而引起诸如肝豆状核变性疾病、阿耳茨海默氏早老性痴呆病等多种铜代谢疾病[4].同样, Zn2+生理平衡的破坏也会引发包括帕金森病、肌萎缩性侧索硬化和癫痫发作等在内的多种健康疾病[5].因此, 这两种离子的检测具有非常重要的意义[6, 7].
金属离子的检测方法有很多种, 近年来荧光探针法因操作简单、检测成本低、高选择性和高灵敏度被广泛地应用于金属离子的检测中[8~12].其中, 吡唑啉荧光探针更因其优良的蓝光发射以及高的荧光量子产率而受到广泛关注[13, 14].到目前为止, 能识别Cu2+和Zn2+的吡唑啉荧光探针已有大量报道, 然而现有探针的主要缺点是可逆性较差[15]及水溶性不好[16].此外, 可通过不同荧光现象同时识别Cu2+和Zn2+的双功能吡唑啉荧光探针至今无报道出现.
基于上述因素, 本工作设计合成了一个基于双吡唑啉结构的荧光探针, 分子中两个吡唑啉荧光团的引入有助于增加探针分子荧光量子产率, 同时分子骨架的增长亦可使共轭效应增大, 诱导发射光谱红移, 进而使探针斯托克斯位移增大.光谱研究表明, 探针C1可在HEPES缓冲溶液中可逆识别Cu2+和Zn2+.探针中两个吡唑啉荧光团的存在, 使探针可通过激基缔合机理以荧光增强现象识别Zn2+, 同时探针也可通过其它络合机理以荧光淬灭现象识别Cu2+, 两种离子的识别均不受其它共存离子的干扰.探针化合物C1合成路线如Scheme 1所示.
1 结果与讨论
1.1 探针C1的光谱性能研究
1.1.1 探针C1对金属离子的选择性识别
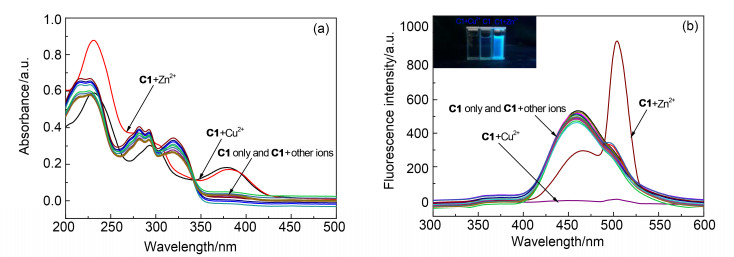
探针C1(10-5 mol·L-1)的紫外-可见吸收光谱如图 1a所示. C1与金属离子结合之前在220, 283和323 nm处有吸收峰.加入2 equiv. Cu2+后, 323 nm处吸收峰消失, 同时在382 nm处出现一个新的吸收峰.在加入2 equiv. Zn2+后, 吸收峰出现了同样的变化, 只是新峰出现在了380 nm.在加入2 equiv.其它金属离子(Na+, K+, Ag+, Hg2+, Ca2+, Co2+, Mg2+, Ba2+, Cd2+, Al3+, Fe3+, Mn2+, Cr3+, Pb2+, Fe2+)时, 吸收光谱并无明显变化.
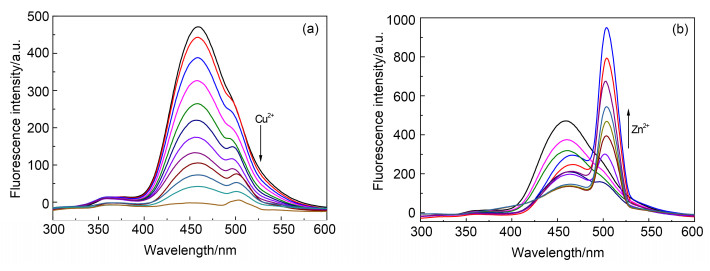
探针C1(10-5 mol·L-1)的荧光光谱如图 1b所示.激发波长为250 nm时, 探针C1在460 nm出现一个无精细结构的荧光峰.在加入2 equiv.各种金属离子(Cu2+, Zn2+, Na+, K+, Ag+, Hg2+, Ca2+, Co2+, Mg2+, Ba2+, Cd2+, Al3+, Fe3+, Mn2+, Cr3+, Pb2+, Fe2+)时, 仅Cu2+和Zn2+对此荧光峰有明显的改变, 其余离子均不能引起荧光光谱的变化.此外, 加入Cu2+时, 溶液的颜色在365 nm紫外灯照射下由荧光蓝变为无荧光, 而加入Zn2+时则变为亮蓝色, 荧光更为强烈(图 1b插图).上述结果表明: C1对Cu2+和Zn2+均有良好的选择性, 并且可以作为双功能荧光探针以两种不同的荧光现象对这两种离子的识别加以区分.
1.1.2 探针C1与目标离子的线性关系
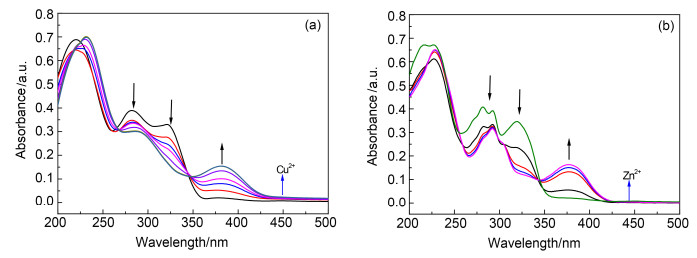
探针C1(10-5 mol·L-1)在不同浓度目标离子存在时的紫外-可见吸收光谱如图 2a, 2b所示.随着Cu2+ (0~1 equiv.)或Zn2+ (0~2 equiv.)浓度的增加, 探针C1在323 nm的吸收峰逐渐降低, 同时在380 nm左右逐渐出现一个的新的峰, 可以判定这个新的吸收峰是C1与目标离子络合后所生成的络合物的峰.
如图 3a所示, 向探针C1的溶液中逐渐加入Cu2+(0~1 equiv.)时, C1在460 nm的荧光峰迅速降低, 当Cu2+浓度达到10-5 mol·L-1时, 此荧光峰完全消失, 探针C1的荧光完全淬灭.如图 3b所示, 在同样条件下将Zn2+ (0~2 equiv.)逐渐加入C1的溶液中, 随着460 nm处荧光峰的降低, 在504 nm出现了一个非常明显的新的发射带.通过探针C1的10次荧光强度相对标准偏差得到Cu2+和Zn2+的最低检测限分别为0.018和0.029 μmol·L-1[17].
1.1.3 络合常数Ka的测定
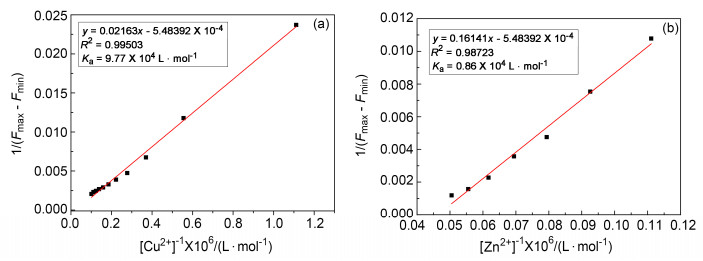
根据上述荧光滴定数据, 以[Cu2+]-1或[Zn2+]-1为横坐标, 以1/(Fmax-Fmin)为纵坐标进行线性拟合, 得到Benesi-Hildebrand曲线(图 4a, 4b), 并通过Benesi-Hildebrand方程计算得到C1-Cu2+以及C1-Zn2+的络合常数分别为9.77×104和0.86×104 L·mol-1.
1.1.4 探针C1与目标离子的络合比
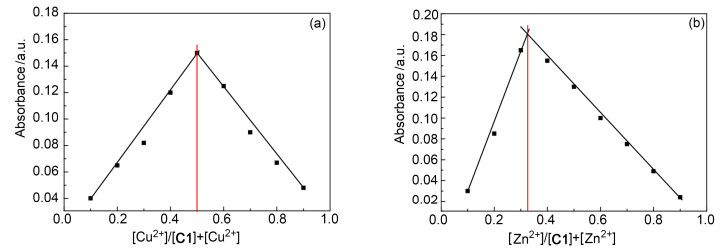
为了进一步确定探针C1与目标离子之间的络合比, 利用Job’s Plot方法, 保持C1与目标离子的总浓度为10-5 mol·L-1, 以目标离子的摩尔浓度比为横坐标, 分别以382 (Cu2+)和380 nm (Zn2+)处的吸光度为纵坐标, 绘制了探针C1与两种目标离子的络合曲线, 如图 5a, 5b所示.当Cu2+的摩尔浓度比为0.5时吸光度最大, 当Zn2+的摩尔浓度比为0.3时吸光度最大, 这就意味着探针C1与Cu2+的络合比为1: 1与Zn2+的络合比为1: 2.
1.1.5 常见金属离子的干扰性
为了探究其它金属离子对探针C1与目标离子络合的干扰性, 在C1的溶液加入2 equiv.的目标离子后, 再分别加入4 equiv.其它金属离子(Na+, K+, Ag+, Hg2+, Ca2+, Co2+, Mg2+, Ba2+, Cd2+, Al3+, Fe3+, Mn2+, Cr3+, Pb2+, Fe2+), 分别记录460 nm (Cu2+)和504 nm (Zn2+)处的荧光强度变化, 如图 6a, 6b所示.竞争实验表明:其余离子均对探针与目标离子的络合无显著影响, 即探针C1对目标离子的识别具有较高的选择性.
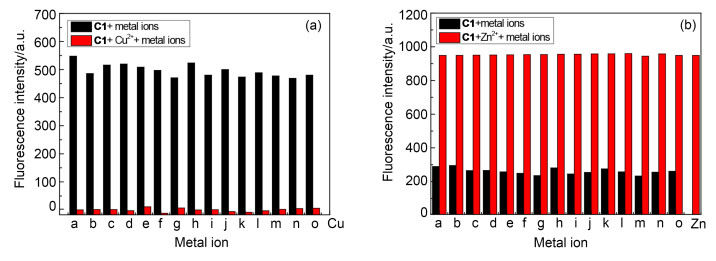 图6
C1(10-5mol·L-1)的HEPES缓冲溶液中分别加入4 equiv.各种金属离子后再加入(a) 2 equiv. Cu2+后于460 nm及(b) 2 equiv. Zn2+后于504 nm的荧光强度
Figure6.
Fluorescence properties of probe C1(10-5 mol·L-1) in HEPES buffer solution at (a) 460 nm for Cu2+ (2 equiv.) and (b) 504 nm for Zn2+ (2 equiv.) in the presence of various metal ions (4 equiv.)
图6
C1(10-5mol·L-1)的HEPES缓冲溶液中分别加入4 equiv.各种金属离子后再加入(a) 2 equiv. Cu2+后于460 nm及(b) 2 equiv. Zn2+后于504 nm的荧光强度
Figure6.
Fluorescence properties of probe C1(10-5 mol·L-1) in HEPES buffer solution at (a) 460 nm for Cu2+ (2 equiv.) and (b) 504 nm for Zn2+ (2 equiv.) in the presence of various metal ions (4 equiv.)
1.1.6 探针C1的可逆性研究
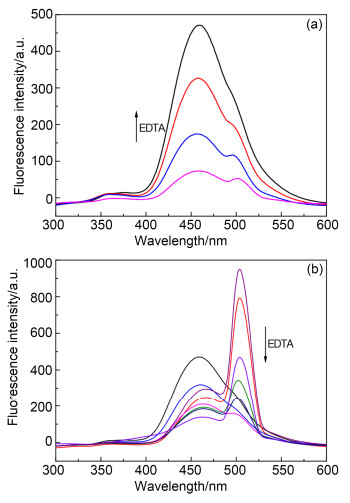
众所周知, 探针的可逆性是其能够参与实际应用的重要因素, 因此进行了探针可逆性的研究.如图 7a和7b所示, 随着C1-Cu2+和C1-Zn2+体系中乙二胺四乙酸(EDTA)的加入, 荧光逐渐恢复至初使状态.这就意味着EDTA与目标离子的络合能力比C1更强, 探针C1可重复使用进而参与到实际应用中.
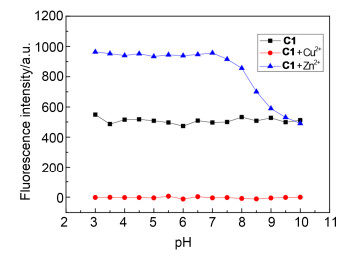
1.1.7 pH的影响研究
pH的影响也是探针能否参与实际应用的重要的因素, 因此进行了不同pH值对探针C1, C1-Cu2+以及C1-Zn2+荧光强度的影响研究, 如图 8所示.探针C1以及C1-Cu2+的荧光强度在pH 3.0到10.0的范围内没有明显的变化, 而C1-Zn2+的荧光强度随pH的变化较为明显, 在pH 3.0到7.5的区间内, C1-Zn2+络合物的荧光强度没有明显变化, 而在pH 7.5到10.0的区间内却逐渐减小.
1.2 探针C1与目标离子的识别机理研究
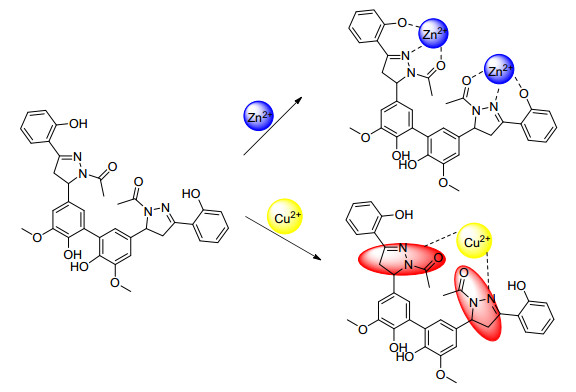
基于C1的光谱性质以及相关文献对C1与目标离子的络合机理进行了推测, 未加金属离子之前, C1呈现出一个无精细结构的宽峰, 此峰很可能是C1的两个吡唑啉荧光团因分子内π-π作用所形成的激基缔合物的峰, 因同一分子中存在两个相同荧光团而形成激基缔合物的现象已有文献报道[18].当C1与Zn2+络合之后, 460 nm处的宽峰逐渐降低, 随之出现的是504 nm处尖锐的荧光增强峰.根据文献报道, Zn2+很容易与吡唑啉环上的N、酰基上的O以及苯酚上的羟基O形成三齿络合物进而产生荧光增强现象[19], 而光谱红移可能是金属离子与探针络合后使主轴变得更平坦而增强共轭性所致.
当C1与Cu2+络合后, 460 nm处激基缔合物的峰逐渐降低直至消失, 根据相关文献, Cu2+很容易与吡唑啉环部位络合进而导致荧光淬灭[20], 结合323 nm处吡唑啉特征吸收峰的消失以及探针与Cu2+的络合比, 很容易断定是探针C1的两个吡唑啉基团与一分子Cu2+产生了络合并导致了荧光淬灭现象(Scheme 2).
2 结论
设计合成了基于双吡唑啉结构的荧光探针C1, 以紫外吸收光谱和荧光光谱探究了探针C1在HEPES缓冲溶液中对金属离子的识别性能.结果表明, 探针C1可高效、可逆地识别Cu2+和Zn2+, 并不受其他共存离子的干扰, 同时此探针可通过两种不同的荧光现象达到对识别离子的区分.
3 实验部分
3.1 仪器与试剂
XRC-1型显微熔点仪(四川大学科学仪器厂); Bruker Avance 400型核磁共振仪(TMS为内标, CDCl3作溶剂); FE06CN-IF171(ZB)LD/LM荧光分光光度计(VARIAN公司); Cary 50紫外-可见分光光度计(美国Varian公司); Esquire6000离子阱质谱仪(Bruker Daltonics公司).
化合物1~4根据文献[21~24]合成得到, 其余实验所用药品及试剂均为国产市售化学纯或分析纯, 使用前未经进一步纯化, 实验用水为二次蒸馏水.
3.2 实验方法
3.2.1 1, 1'-(5, 5'-(6, 6'-二羟基-5, 5'-二甲氧基联苯-3, 3'-二基)双(3-(2-羟基苯基)-1H-吡唑-5, 1-(4H, 5H)-二基))二乙酮(C1)的合成
将0.7147 g (1.0 mmol)查尔酮4和0.15 mL 80%的水合肼溶解于15 mL冰乙酸中, 搅拌下加热回流, 薄层色谱(TLC)监测反应进程(约需3 h).反应完成后降至室温, 有黄色固体析出, 抽滤, 干燥, 乙醇重结晶即得0.4233 g探针C1纯品, 产率62%. m.p. 179~181 ℃; 1H NMR (400 MHz, CDCl3) δ: 10.239 (s, 2H, OH), 10.205 (s, 2H, OH), 7.343~6.725 (m, 12H, ArH), 5.451 (dd, J=2.8, 7.6 Hz, 2H, pyrazoline-H), 3.808 (s, 6H, OCH3), 3.783~3.754 (m, 2H, pyrazoline-H), 3.310 (dd, J=2.8, 11.64 Hz, 2H, pyrazoline-H), 2.335 (s, 3H, OCH3), 2.293 (s, 3H, OCH3); 13C NMR (100 MHz, CDCl3) δ: 168.13 (s, 2C, CO), 157.75 (s, 2C, ArC), 156.77 (s, 1C, pyrazoline C), 156.68 (s, 1C, pyrazoline C), 147.67 (s, 1C, ArC), 147.60 (s, 1C, ArC), 142.60 (s, 2C, ArC), 133.14 (s, 1C, ArC), 133.06 (s, 1C, ArC), 132.37 (s, 2C, ArC), 128.66 (s, 2C, ArC), 124.68 (s, 1C, ArC), 124.66 (s, 1C, ArC), 120.50 (s, 1C, ArC), 120.31 (s, 1C, ArC), 119.91 (s, 1C, ArC), 119.8 (s, 1C, ArC), 117.11 (s, 2C, ArC), 116.21 (s, 2C, ArC), 108.49 (s, 1C, ArC), 108.32 (s, 1C, ArC), 58.41 (s, 1C, pyrazoline C), 56.28 (s, 1C, pyrazoline C), 42.89 (s, 1C, OCH3), 42.79 (s, 1C, OCH3), 29.79 (s, 2C, pyrazoline C), 22.17 (s, 1C, OCH3), 22.10 (s, 1C, OCH3); ESI-MS m/z: 651 (M+1). Anal. calcd for C36H34N4O8: C 65.77, H 5.23, N 8.61; found C 65.75, H 5.27, N 8.61.
3.2.2 光谱测定方法
配置探针分子C1(10-3mol·L-1)的甲醇溶液, 用HEPES缓冲溶液稀释至10-5 mol·L-1, 以二次蒸馏水配置金属离子(Cu2+, Zn2+, Na+, K+, Ag+, Hg2+, Ca2+, Co2+, Mg2+, Ba2+, Cd2+, Al3+, Fe3+, Mn2+, Cr3+, Pb2+, Fe2+)的盐酸盐或硝酸盐溶液(2.0×10-3 mol·L-1)用于紫外-可见光谱和荧光光谱测定.
室温下, 保持激发狭缝与发射狭缝均为5.0 nm, 激发波长为250 nm, 在200~600 nm波长范围内测定探针C1的荧光性能, 以及分别加入不同量的金属离子后的各项光谱性能.
辅助材料(Supporting Information) 探针C1的核磁共振氢谱(1H NMR)、碳谱(13C NMR)谱图及ESI-MS图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)下载
-
-
[1]
Carver, P. L. In Metal Ions in Life Sciences, Vol. 13, Eds.:Sigel, A.; Sigel, H.; Sigel, R. K. O., Springer, New York, 2013, pp. 2~5.
-
[2]
Waggoner, D. J.; Bartnikas, T. B.; Gitlin, J. D. Neurobiol. Dis. 1999, 6, 221. doi: 10.1006/nbdi.1999.0250
-
[3]
Vallee, B. L.; Falchuk, K. H. Physiol. Rev. 1993, 73, 79.
-
[4]
Strausak, D.; Mercer, J. F.; Dieter, H. H.; Stremmel, W.; Multhaup, G. Brain Res. Bull. 2001, 55, 175. doi: 10.1016/S0361-9230(01)00454-3
-
[5]
Cuajungco, M. P.; Lees, G. J. Neurobiol. Dis. 1997, 4, 137. doi: 10.1006/nbdi.1997.0163
-
[6]
李英俊, 李继阳, 许永廷, 靳焜, 曹欣, 有机化学, 2017, 37, 896. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345878.shtmlLi, Y. J.; Li, J. Y.; Xu, Y. T.; Jin, K.; Cao, X. Chin. J. Org. Chem. 2017, 37, 896(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345878.shtml
-
[7]
王智成, 戴博娜, 丘继芳, 葛金柱, 有机化学, 2015, 35, 2383. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345169.shtmlWang, Z. C.; Dai, B. N.; Qiu, J. F.; Ge, J. Z. Chin. J. Org. Chem. 2015, 35, 2383(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345169.shtml
-
[8]
Yao, P. S.; Liu, Z.; Ge, J. Z.; Cao, Q. Y. Dalton Trans. 2015, 44, 7470. doi: 10.1039/C5DT00542F
-
[9]
Ge, J. Z.; Zou, Y.; Yan, Y. H.; Lin, S.; Zhao, X. F.; Cao, Q. Y. J. Photochem. Photobiol. B:Chem. 2016, 315, 67. doi: 10.1016/j.jphotochem.2015.09.011
-
[10]
Zhou, J. L.; Zhang, J.; Ren, H.; Dong, X. C.; Zheng, X.; Zhao, W. L. Chin. J. Chem. 2016, 34, 715. doi: 10.1002/cjoc.v34.7
-
[11]
Zhong, K. L.; Zhao, J.; Zhou, X.; Hou, S. H.; Bian, Y. J.; Li, J. R.; Tang, L. J. Chin. J. Chem. 2016, 34, 1329. doi: 10.1002/cjoc.v34.12
-
[12]
祝文斌, 吕小兰, 朱江华, 曹迁永, 有机化学, 2017, 37, 624. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345851.shtmlZhu, W. B.; Lü, X. L.; Zhu, J. H.; Cao, Q. Y. Chin. J. Org. Chem. 2017, 37, 624(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345851.shtml
-
[13]
Gong, Z. L.; Ge, F.; Zhao, B. X. Sensor Actuators, B:Chem. 2011, 159, 148. doi: 10.1016/j.snb.2011.06.064
-
[14]
Hu, S. L.; Zhang, S. S.; Hu, Y.; Tao, Q.; Wu, A. X. Dyes Pigm. 2013, 96, 509. doi: 10.1016/j.dyepig.2012.09.019
-
[15]
Yang, A. B.; Wu, J.; Xu, Z. X.; Wang, B. X. Chem. J. Chin. Univ. 2011, 10, 2306.
-
[16]
张应鹏, 尤彩霞, 杨云裳, 刘小育, 郭慧琛, 董玉莹, 有机化学, 2016, 36, 1401. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345443.shtmlZhang, Y. P.; You, C. X.; Yang, Y. S.; Liu, X. Y.; Guo, H. C.; Dong, Y. Y. Chin. J. Org. Chem. 2016, 36, 1401(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345443.shtml
-
[17]
Liu, Y.; Wang, S. Q.; Zhao, B. X. RSC Adv. 2015, 5, 32962. doi: 10.1039/C5RA04933D
-
[18]
Chandrasekhar, V.; Pandey, M. D. Tetrahedron Lett. 2011, 52, 1938. doi: 10.1016/j.tetlet.2011.02.051
-
[19]
Zhang, T. T.; Wang, F. W.; Li, M. M.; Liu, J. T.; Miao, J. Y.; Zhao, B. X. Sensor Actuators, B:Chem. 2013, 186, 755. doi: 10.1016/j.snb.2013.06.085
-
[20]
Li, M. M.; Zhao, W. B.; Zhang, T. T.; Fan, W. L.; Xu, Y.; Xiao, Y.; Miao, J. Y.; Zhao, B. X. J. Fluoresc. 2013, 23, 1263. doi: 10.1007/s10895-013-1259-x
-
[21]
Kobayashi, T.; Sasaki, S.; Tomita, N.; Fukui, S.; Kuroda, N.; Nakayama, M.; Kiba, A.; Takatsu, Y.; Ohtaki, T.; Itoh, F.; Baba, A. Bioorg. Med. Chem. 2010, 18, 3841. doi: 10.1016/j.bmc.2010.04.036
-
[22]
Delomenède, M.; Bedos-Belval, F.; Duran, H.; Vindis, C.; Baltas, M.; Nègre-Salvayre, A. J. Med. Chem. 2008, 51, 3171. doi: 10.1021/jm7014793
-
[23]
Thévenin, M.; Mouray, E.; Grellier, P.; Dubois, J. Eur. J. Org. Chem. 2014, 2014, 2986.
-
[24]
Yang, L. X.; Huang, K. X.; Li, H. B.; Gong, J. X.; Wang, F.; Feng, Y. B.; Tao, Q. F.; Wu, Y. H.; Li, X. K.; Wu, X. M.; Zeng, S.; Spencer, S.; Zhao, Y.; Qu, J. J. Med. Chem. 2009, 52, 7732. doi: 10.1021/jm900735p
-
[1]
-
图 6 C1(10-5mol·L-1)的HEPES缓冲溶液中分别加入4 equiv.各种金属离子后再加入(a) 2 equiv. Cu2+后于460 nm及(b) 2 equiv. Zn2+后于504 nm的荧光强度
Figure 6 Fluorescence properties of probe C1(10-5 mol·L-1) in HEPES buffer solution at (a) 460 nm for Cu2+ (2 equiv.) and (b) 504 nm for Zn2+ (2 equiv.) in the presence of various metal ions (4 equiv.)
(a) Na+, (b) K+, (c) Ag+, (d) Hg2+, (e) Ca2+, (f) Co2+, (g) Mg2+, (h) Ba2+, (i) Cd2+, (j) Al3+, (k) Fe3+, (l) Mn2+, (m)Cr3+, (n) Pb2+, (o) Fe2+
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 2460
- HTML全文浏览量: 264


 下载:
下载:









 下载:
下载:

