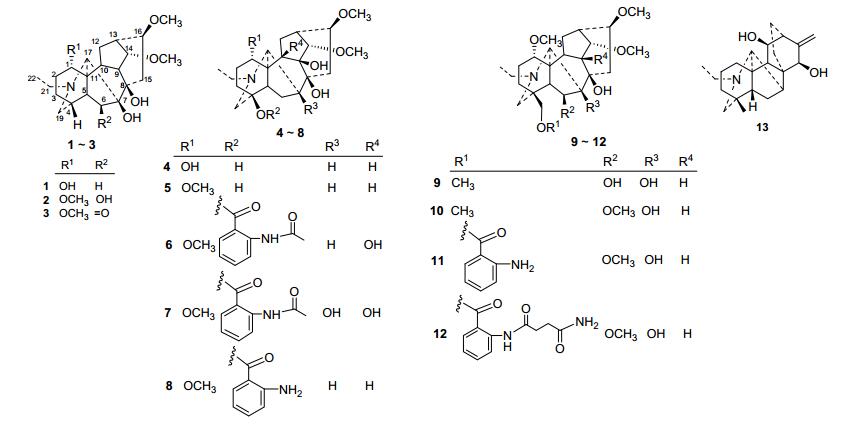
 图 1
从白喉乌头中分离得到的二萜生物碱
Figure 1.
Diterpenoid alkaloids isolated from Aconitum leucostomum
图 1
从白喉乌头中分离得到的二萜生物碱
Figure 1.
Diterpenoid alkaloids isolated from Aconitum leucostomum

Citation: Chen Lin, Wang Qian, Huang Shuai, Shan Lianhai, Gao Feng, Zhou Xianli. Diterpenoid Alkaloids from Aconitum leucostomum and Their Antifeedant Activity[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1839-1843. doi: 10.6023/cjoc201702021

白喉乌头中二萜生物碱及其拒食活性研究
-
关键词:
- 乌头属
- / 白喉乌头
- / 二萜生物碱
- / leucostonine
- / 拒食活性
English
Diterpenoid Alkaloids from Aconitum leucostomum and Their Antifeedant Activity
-
Key words:
- aconitum
- / Aconitum leucostomum
- / diterpenoid alkaloid
- / leucostonine
- / antifeedant activity
-
二萜生物碱由于其结构的复杂多样性, 同时又具有消炎、镇痛、抗心律失常、抗真菌、抗癌以及杀虫和拒食等多种生物活性而越来越受到人们的关注, 其主要分布在乌头属、翠雀属和飞燕草属中[1].白喉乌头(Aconitum leucostomum Vorosch.)为毛茛科乌头属植物, 主要分布于中国新疆、甘肃西北部(山丹), 哈萨克斯坦也有分布[2].据《哈萨克药志》记载, 白喉乌头在哈萨克民族作为草乌的代用品使用, 其味辛、热、苦、大毒, 有祛风除湿、温经止痛的功能, 常用于风寒湿痹等疾病, 为西北少数民族常用民间草药之一.对白喉乌头中的化学成分研究已有报道[3], 本课题组对白喉乌头中的药用成分进一步研究, 分离得到13个二萜生物碱, 用HR-ESI-MS、IR、1D NMR和2D NMR等波谱技术以及与文献对比等方法确定了它们的结构(图 1), 其中一个为新的二萜生物碱leucostonine (1), 另外12个已知化合物包括7个C18型二萜生物碱: acosepticine (2), 喉乌碱(leucostine, 3), 刺乌定(lappaconidine, 4), 刺乌宁(lapaconine, 5), N-acetylsepaconitine (6), 赣乌碱(finaconitine, 7)和N-去乙酰高乌甲素(N-deacetylappa-conitine, 8), 4个C19型二萜生物碱: acosanine (9), delphatine (10), 氨茴酰基牛扁碱(anthranoyllycoctonine, 11)和东乌头定(avadharidine, 12), 以及一个C20型二萜生物碱裸翠雀亭(denudatine, 13).同时考察了其中12个化合物对甜菜夜蛾幼虫的拒食活性.
1 结果与讨论
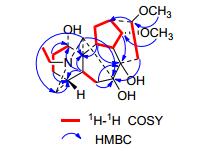
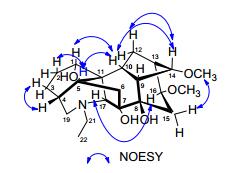
化合物1为白色固体, 碘化铋钾显阳性; 通过HR-ESI-MS图谱可知该化合物分子式为C22H35NO5(m/z: 394.2584 [M+H]+, calcd for 394.2593). IR图谱显示化合物1中存在羟基(3392 cm-1).结合化合物1的1H NMR、13C NMR图谱和DEPT谱, 表明其含有一个氮乙基[δH 1.09 (t, J=7.2 Hz, 3H); δC 50.6 t, 13.9 q], 两个甲氧基[δH 3.40 (s, 3H), δC 57.8 q; δH 3.35 (s, 3H), δC (56.4 q)].进一步分析13C NMR与DEPT图谱可知化合物1中还有18个碳原子, 分别是6个亚甲基(δC 24.0, 29.4, 29.9, 36.4, 37.3和53.6), 9个次甲基(δC 33.7, 37.1, 40.4, 43.3, 47.0, 65.0, 72.6, 82.8和85.0) 和3个季碳(δC 49.2, 77.4和86.2), 推测该化合物应为C18型二萜生物碱[4]. 13C NMR数据可知化合物1中含有五个含氧取代的碳信号, 除两个甲氧基以外, 推测化合物1中还含有3个羟基. HMBC图谱(图 2)中, 两个甲氧基信号[δH 3.40, 3.35 (each s, 3H)]分别与C-14 (δC 85.0) 和C-16 (δC 82.8) 有远程相关, 可知2个甲氧基分别位于C-14和C-16位.分析HMBC图谱, H-2 (δH 1.55) 和H-5 (δH 1.85) 与C-1 (δC 72.6) 有相关, 同时, 在1H NMR中H-1 (δH 3.64) 为一个宽单峰且C-1的核磁数据为δC 72.6, 可知C-1连有一个α构型的羟基[5].进一步分析HMBC图谱, H-6α(δH 1.43) 和H-15α (δH 2.92) 与C-7 (δC 86.2) 有相关, H-6 (δH1.43; δH 2.43), H-10 (δH1.79) 和H-14 (δH 3.72) 与C-8 (δC 77.4) 有远程相关, 可以确定余下的两个羟基位于C-7和C-8位. NOESY图谱中H-1和H-10, H-10和H-14, H-16和H-17有相关, 可以进一步确定C-1的羟基应该为α构型, C-14位甲氧基为α构型, 而C-16位甲氧基为β构型.综上所述, 化合物1的结构鉴定为leucostonine (1) (图 1).
化合物2~13为已知化合物, 经波谱分析与文献数据对照, 将它们鉴定为acosepticine (2)[6], 喉乌碱(3)[7], 刺乌定(4)[8], 刺乌宁(5)[9], N-acetylsepaconitine (6)[10], 赣乌碱(7)[11], N-去乙酰高乌甲素(8)[12], acosanine (9)[12], delphatine (10)[13], 氨茴酰基牛扁碱(11)[14], 东乌头定(12)[15]和裸翠雀亭(13)[16].其中, 化合物2, 4~7, 9, 12和13为首次从该植物中分离得到.
采用选择性叶碟法考察了白喉乌头中7个C18, 4个C19和1个C20二萜生物碱对甜菜夜蛾(Spodoptera exigua Hiibner) 3龄幼虫的拒食活性, 以乌头碱为对照, 结果见表 2.从表中可以看出, C18二萜生物碱中, 活性最好的化合物分别是6, 7和8 (EC50<2 mg/cm2), 其次是2, 4和1 (EC50=8~21 mg/cm2), 化合物3基本没有活性(EC50>30 mg/cm2); 这也是首次对C18型二萜生物碱的拒食活性进行研究报道.另外, 在C19二萜生物碱中, 化合物11和12对甜菜夜蛾拒食作用较强(EC50<1 mg/ cm2), 而9和10的作用相对较差(EC50≈7 mg/cm2), 这说明C-18位是否有邻氨基苯甲酰衍生物的取代对其活性可能有较大影响. C20二萜生物碱13对甜菜夜蛾基本没有活性(EC50>60 mg/cm2).
2 实验部分
2.1 仪器与试剂
核磁共振仪(Brucker AVANCE DRX-400和600), 超高效液相色谱仪(ACQUITY UPLC I-Class)与四级杆飞行时间质谱仪(Xevo G2-S QTof) (waters公司), 差示扫描量热仪(Netzsch Jupiter STA 449C), 傅立叶红外光谱仪(Thermo Fisher Nicolet 6700), 自动精密旋光仪(Perkin-Elmer 341).层析用YMC反相硅胶填料, 层析用氧化铝(上海陆都化学试剂厂), 层析用硅胶G和H(青岛海洋化工厂), 其余试剂为分析纯.
2.2 实验样品
白喉乌头于2015年8月采自于新疆伊犁尼勒克县, 由中国科学院华南植物园杨亲二研究员鉴定为白喉乌头(Aconitum leucostomum Worosch.), 样品(No. C. Ren & L. Wang 735) 保存于中国科学院华南植物园.
2.3 提取与分离
干燥白喉乌头及地上部分(10 kg)粉碎后, 0.1 mol/L盐酸冷浸6次, 每次3 d, 滤去残渣, 用饱和碳酸钠水溶液调至中性, 再用氨水碱化至pH 9~10, 用CH2Cl2萃取, 每次5 L, 共4次, 合并萃取液, 减压浓缩, 得总生物碱(40 g).
总生物碱A (40 g)经过硅胶柱层析[100~200目硅胶400 g, 二氯甲烷-甲醇(1%二乙胺), V:V=100:1→0:1]梯度洗脱, 洗脱液经TLC检查合并为A1~A4四个部分.
A1部分经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=60:1→4:1]洗脱得到组分A1-1和组分A1-2; 组分A1-1经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=40:1→8:1]洗脱得到化合物3 (22 mg)和4 (14 mg); 组分A1-2经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=20:1→1:1]梯度洗脱得到A1-2-1和A1-2-2两个组分, A1-2-1组分用[石油醚-丙酮(1%二乙胺), V:V=15:1]洗脱得化合物1 (27 mg)和2 (15 mg); 反相硅胶柱层析(甲醇-水, V:V=1:9) 分离组分A1-2-2得化合物5 (4 mg). A2部分经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=40:1→1:1]洗脱得A2-1和A2-2两个组分, A2-1组分经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=15:1→1:1]洗脱得化合物6 (13 mg); 反相硅胶柱层析(甲醇-水, V:V=6:4) 分离组分A2-2得化合物7 (19 mg). A3部分经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=20:1→1:1]洗脱得到A3-1~A3-3三个组分, 用石油醚丙酮重结晶A3-1得到化合物8 (14 mg); A3-2部分经硅胶柱层析[石油醚/丙酮(1%二乙胺), V:V=20:1→1:1]得化合物9 (12 mg)和10 (26 mg); 组分A3-3经硅胶柱层析[石油醚-丙酮(1%二乙胺), V:V=20:1]分离, 再用碱性氧化铝柱层析(氯仿-甲醇, V:V=15:1) 纯化得化合物11 (23 mg); A4部分经硅胶柱层析(二氯甲烷-甲醇, V:V=45:0→0:1) 梯度洗脱得到A4-1和A4-2两个组分, A4-1用反相柱层析(甲醇-水, V:V=4:1) 得化合物12 (22 mg), 用碱性氧化铝柱层析(氯仿-甲醇, V:V=20:1) 分离组分A4-2得化合物13 (16 mg).
leucostonine (1):白色固体. m.p. 258.6~259.1℃; [α]20 D -24 (c 0.30, CHCl3); 1H NMR (400 MHz, CDCl3)及13C NMR (100 MHz, CDCl3)数据见表 1; IR (KBr) νmax: 3392, 2934, 2819, 2671, 1631, 1602, 1492, 1463, 1384, 1347, 1329, 1299, 1214, 1118, 1098, 1062, 1033, 1010, 997, 978, 961 cm-1. HR-ESI-MS calcd for C22H36NO5[M+H]+ 394.2593, found 394.2584.
 表 1
化合物1的核磁共振图谱数据(400 MHz for 1H NMR, 100 MHz for 13C NMR, CDCl3)
Table 1.
NMR spectroscopic data of compound 1(400 MHz for 1H NMR, 100 MHz for 13C NMR, CDCl3)
表 1
化合物1的核磁共振图谱数据(400 MHz for 1H NMR, 100 MHz for 13C NMR, CDCl3)
Table 1.
NMR spectroscopic data of compound 1(400 MHz for 1H NMR, 100 MHz for 13C NMR, CDCl3)
No. 1H NMR 13C NMR 1 3.64 br.s 72.6 d 2 1.55a(α, β) 29.4 t 3 1.61a(β) 24.0 t 1.98a(α) 4 1.98a 33.7 d 5 1.85 m 40.4 d 6 1.43 d (14.4)(α) 37.3 t 2.43a(β) 7 — 86.2 s 8 — 77.4 s 9 2.20 dd (4.8, 7.2) 47.0 d 10 1.79 m 43.3 d 11 — 49.2 s 12 1.63 m(α) 29.9 t 1.98a(β) 13 2.43a 37.1 d 14 3.72 t (4.8) 85.0 d 15 1.61a(β) 36.4 t 2.92a(α) 16 3.26 t (8.4) 82.8 d 17 2.63 br.s 65.0 d 19 2.53 d (11.2)(α) 53.6 t 3.16 dd (4, 11.2) (β) 21 2.92a 50.6 t 22 1.09 t (7.2) 13.9 q 14-OCH3 3.40 s 57.8 q 16-OCH3 3.35 s 56.4 q aOverlapped signals.  表 2
白喉乌头中二萜生物碱对甜菜夜蛾的拒食活性
Table 2.
Antifeedant activities of the diterpenoid alkaloids isolated from A. leucostomum against Spodoptera exigua Hiibner (n=3)
表 2
白喉乌头中二萜生物碱对甜菜夜蛾的拒食活性
Table 2.
Antifeedant activities of the diterpenoid alkaloids isolated from A. leucostomum against Spodoptera exigua Hiibner (n=3)
Compd. EC50/(mg·cm-2)
(95% confidence limit)1 20.75 (14.09, 30.54) 2 8.59 (5.98, 12.36) 3 >30 4 17.65 (11.10, 28.07) 5 nta 6 (0.85, 1.73) 7 1.45 (0.75, 2.81) 8 1.88 (1.12, 3.18) 9 6.34 (2.66, 15.09) 10 6.75 (3.01, 15.12) 11 0.73 (0.33, 1.62) 12 0.84 (0.49, 1.45) 13 >60 Aconitine 0.02 (0.01, 0.11) ant: not test (insufficient compound available). 2.4 拒食活性
甜菜夜蛾, 在温度为(27±1) ℃, 湿度为70%~80%, 光周期为14:10 h (L:D)的条件下饲养, 挑选虫体均匀一致、健壮并饥饿6 h的3龄幼虫进行试验.
采用González-Coloma等[17]推荐的选择性叶碟法进行活性测定:用打孔器将新鲜甘蓝叶片裁成直径2 cm的叶碟, 在表面均匀涂上15 mL药液(处理组)或空白液(对照组).分别将两片对照组和处理组叶片放置于直径为15 cm的培养皿中, 待液体风干后, 每皿放入6头饥饿6 h的幼虫.每个处理重复三次. 24 h后用方格纸片法测定取食面积, 并用以下公式计算拒食率: FR%=(CK-T)/CK×100%.其中CK为对照组叶片取食面积, T为药剂处理组叶片取食面积.
对于FR>50%的化合物测试其EC50值(引起50%个体有效的剂量). EC50值测定方法:依据初筛的浓度, 采用梯度稀释法配制一系列浓度的药液, 按照前述方法进行试验, 测定取食面积, 计算拒食率, 并通过线性回归曲线计算相应的EC50值.
辅助材料(Supporting Information) IR, HR-ESI-MS, 1D NMR和2D NMR图谱, 这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
肖培根, 王锋鹏, 高峰, 闫路平, 陈东林, 刘勇, 植物分类学报, 2006, 44, 1.Xiao, P.-G.; Wang, F.-P.; Gao, F.; Yan, L.-P.; Chen, D.-L.; Liu, Y. Acta Phytotaxon. Sin. 2006, 44, 1(in Chinese).
-
[2]
中国科学院植物所, 中国医学科学院药物所, 中国植物志, 科学出版社, 北京, 1979, Vol. 27, p. 171.Institute of Botany, Chinese Academy of Sciences and Institute of Materia Medica, Chinese Academy of Medical Sciences, Flora Reipublicae Populais Sinica, Vol. 27, Science Press, Beijing, 1979, p. 171(in Chinese).
-
[3]
(a) Xu, W.-L.; Chen, C.; Shan, L.-H.; Gao, F.; Huang, S.; Zhou, X.-L. Heterocycles 2016, 92, 2059.
(b) Yue, J.-M.; Xu, J.; Zhao, Q.-S.; Sun, H.-D.; Chen, Y.-Z. J. Nat. Prod. 1996, 59, 277.
(c) Telnov, V. A.; Yunusov, M. S.; Abdullaev, N. D.; Zhamierashvili, M. G. Khim. Prir. Soedin 1988, 4, 556.
(d) Wei, X.-Y.; Wei, B.-Y.; Zhang, J. Acta Bot. Sinica 1996, 38, 995. -
[4]
Shan, L.-H.; Zhang, J.-F.; Chen, L.; Wang, J.-X.; Huang, S.; Zhou, X.-L. Nat. Prod. Commun. 2015, 10, 2067.
-
[5]
Chen, L.; Shan, L.-H.; Xu, W.-L.; Zhang, J.-F.; Huang, S.; Zhou, X.-L. Nat. Prod. Res. 2017, 31, 523. doi: 10.1080/14786419.2016.1198348
-
[6]
Sayed, H. M.; Desai, H. K.; Ross, S. A., Pelletier, S. W.; Aasen, A. J. J. Nat. Prod. 1992, 55, 1595. doi: 10.1021/np50089a006
-
[7]
魏孝义, 韦璧瑜, 张继, 植物学报, 1996, 38, 995.Wei, X.-Y.; Wei, B.-Y.; Zhang, J. Acta Bot. Sin. 1996, 38, 995(in Chinese).
-
[8]
彭崇胜, 王建忠, 简锡贤, 王锋鹏, 天然产物研究与开发, 2000, 12, 45. doi: 10.3969/j.issn.1001-6880.2000.02.011Peng, C.-S.; Wang, J.-Z.; Jian, X.-X.; Wang, F.-P. Nat. Prod. Res. Dev. 2000, 12, 45(in Chinese). doi: 10.3969/j.issn.1001-6880.2000.02.011
-
[9]
Ross, S. A.; Pelletier, S. W.; Aasen, A. J. Tetrahedron 1992, 48, 1183. doi: 10.1016/S0040-4020(01)90782-3
-
[10]
蒋山好, 朱元龙, 朱任宏, 药学学报, 1982, 17, 288.Jiang, S.-H.; Zhu, Y.-L.; Zhu, R.-H. Acta Pharm. Sin. 1982, 17, 288(in Chinese).
-
[11]
De la Fuente, G.; Reina, M.; Valencia, E.; Rodriguez-Ojeda, A. Heterocycles 1988, 27, 1109. doi: 10.3987/COM-87-4445
-
[12]
Vaisov, Z. M.; Bessonova I. A. Chem. Nat. Compd. 1992, 28, 463. doi: 10.1007/BF00630651
-
[13]
Yunusov, M. S.; Yunusov, S, Y. Chem. Nat. Compd. 1970, 6, 334. doi: 10.1007/BF00567313
-
[14]
魏孝义, 韦璧瑜, 张继, 中草药, 1995, 26, 344. doi: 10.3321/j.issn:0253-2670.1995.07.019Wei, X.-Y.; Wei, B.-Y.; Zhang, J. Chin. Tradit. Herbal Drugs 1995, 26, 344(in Chinese). doi: 10.3321/j.issn:0253-2670.1995.07.019
-
[15]
Hao, Z.-G.; Liu, J.-H.; Zhao, S.-X.; Miao, Z.-C. Phytochemistry 1991, 30, 3494. doi: 10.1016/0031-9422(91)83244-F
-
[16]
冯锋, 柳文媛, 陈优生, 叶文才, 刘静涵, 赵守训, 中国药科大学学报, 2003, 34, 17. doi: 10.3321/j.issn:1000-5048.2003.01.004Feng, F.; Liu, W.-Y.; Chen, Y.-S.; Ye, W.-C.; Liu, J.-H.; Zhao, S.-X. J. Chin. Pharm. Univ. 2003, 34, 17(in Chinese). doi: 10.3321/j.issn:1000-5048.2003.01.004
-
[17]
(a) Gonzalez-Coloma, A.; Reina, M.; Cabrera, R.; Castañera, P.; Gutierrez, C. J. Chem. Ecol. 1995, 21, 1255.
(b) González-Coloma, A.; Terrero, D.; Perales, A.; Castañera, P.; Fraga, B. M. J. Agric. Food Chem. 1996, 44, 296.
-
[1]
-
表 1 化合物1的核磁共振图谱数据(400 MHz for 1H NMR, 100 MHz for 13C NMR, CDCl3)
Table 1. NMR spectroscopic data of compound 1(400 MHz for 1H NMR, 100 MHz for 13C NMR, CDCl3)
No. 1H NMR 13C NMR 1 3.64 br.s 72.6 d 2 1.55a(α, β) 29.4 t 3 1.61a(β) 24.0 t 1.98a(α) 4 1.98a 33.7 d 5 1.85 m 40.4 d 6 1.43 d (14.4)(α) 37.3 t 2.43a(β) 7 — 86.2 s 8 — 77.4 s 9 2.20 dd (4.8, 7.2) 47.0 d 10 1.79 m 43.3 d 11 — 49.2 s 12 1.63 m(α) 29.9 t 1.98a(β) 13 2.43a 37.1 d 14 3.72 t (4.8) 85.0 d 15 1.61a(β) 36.4 t 2.92a(α) 16 3.26 t (8.4) 82.8 d 17 2.63 br.s 65.0 d 19 2.53 d (11.2)(α) 53.6 t 3.16 dd (4, 11.2) (β) 21 2.92a 50.6 t 22 1.09 t (7.2) 13.9 q 14-OCH3 3.40 s 57.8 q 16-OCH3 3.35 s 56.4 q aOverlapped signals. 表 2 白喉乌头中二萜生物碱对甜菜夜蛾的拒食活性
Table 2. Antifeedant activities of the diterpenoid alkaloids isolated from A. leucostomum against Spodoptera exigua Hiibner (n=3)
Compd. EC50/(mg·cm-2)
(95% confidence limit)1 20.75 (14.09, 30.54) 2 8.59 (5.98, 12.36) 3 >30 4 17.65 (11.10, 28.07) 5 nta 6 (0.85, 1.73) 7 1.45 (0.75, 2.81) 8 1.88 (1.12, 3.18) 9 6.34 (2.66, 15.09) 10 6.75 (3.01, 15.12) 11 0.73 (0.33, 1.62) 12 0.84 (0.49, 1.45) 13 >60 Aconitine 0.02 (0.01, 0.11) ant: not test (insufficient compound available). -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1538
- HTML全文浏览量: 199


 下载:
下载:


 下载:
下载:

