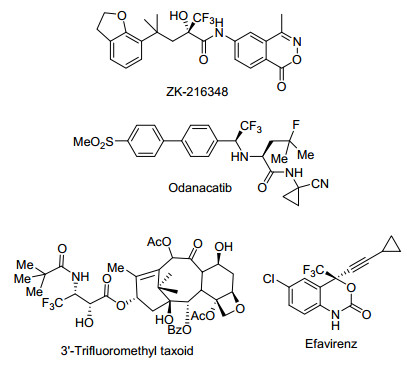
 图 1
含CF3基团的典型药物
Figure 1.
Drugs possessing CF3 group
图 1
含CF3基团的典型药物
Figure 1.
Drugs possessing CF3 group

Citation: Wu Lili, Su Yingpeng, Chong Siying, Zhang Weigang, Huang Danfeng, Wang Kehu, Hu Yulai. Chiral Thiourea Catalyzed Asymmetric Henry Reaction: Construction of Stereogenic Center Bearing a CF3 Group from 2, 2, 2-Trifluoroacetophenone Substrates[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 936-942. doi: 10.6023/cjoc201612006

手性硫脲催化的不对称Henry反应:以2, 2, 2-三氟甲基苯乙酮作为底物构筑含有CF3的手性中心
-
关键词:
- 有机催化
- / 手性硫脲
- / Henry反应
- / 2, 2, 2-三氟甲基苯乙酮
English
Chiral Thiourea Catalyzed Asymmetric Henry Reaction: Construction of Stereogenic Center Bearing a CF3 Group from 2, 2, 2-Trifluoroacetophenone Substrates
-
Key words:
- organocatalyst
- / chiral thiouera
- / Henry reaction
- / 2, 2, 2-trifluoroacetophenone
-
含氟有机化合物因其独特的物理性质和化学性质已被广泛应用于医药、农药和材料领域中[1].三氟甲基取代的化合物是一类典型的含氟化合物.在药物分子或农药分子中引入三氟甲基基团可以增强或改变母体化合物的原有属性, 如改变其生物活性等 (图 1)[2].近年来, 构筑含有三氟甲基取代的手性中心尤为引人关注[3].目前, 已报道许多构建含三氟甲基取代的季碳或杂季碳手性中心的方法.通常, 构筑此类手性中心有两种策略:一是利用亲核、亲电或自由基三氟甲基化试剂直接进行的不对称三氟甲基化反应; 另一种是利用三氟甲基合成砌块进行的不对称转化反应[4].三氟甲基合成砌块由于其廉价易得以及其反应具有高选择性等优势, 业已被广泛应用于三氟甲基取代的手性中心的构筑.且该策略已成为构筑含有三氟甲基取代的手性中心的一种强有力的手段.
Henry反应作为制备β-硝基醇的一种重要的方法已被广泛研究.目前, 已有诸多高效的催化不对称Henry反应被研究、报道[5].其中, 在手性催化剂催化下, 利用2, 2, 2-三氟甲基苯乙酮作为Henry反应受体来构筑含三氟甲基取代的手性中心的方法也已见诸报道[6~8]. 2002年Matsuoto课题组[6b]在研究不对称Henry反应时, 报道了利用奎尼丁作为有机催化剂构筑含三氟甲基取代的手性中心的例子, 其ee值为21%. Bandini等[7]在2008年报道了奎宁衍生物作为有机催化剂催化三氟甲基酮参与的不对称Henry反应. 2011年, Connon课题小组[8]开发了一种基于金鸡纳生物碱的脲类催化剂, 并将该催化剂用于三氟甲基酮的不对称Henry反应.我们课题小组[10]对硫脲有机催化剂催化的不对称氟化及三氟甲基化反应研究具有浓厚的兴趣, 并开展了一定的工作.我们[10b]也利用三氟甲基合成砌块, 在双官能团硫脲催化下成功地构筑了含有三氟甲基基团的手性中心.在此, 我们希望报道简单的手性双官能团硫脲催化下, 2, 2, 2-三氟甲基苯乙酮作为三氟甲基合成砌块发生的不对称Henry反应, 以此构筑含三氟甲基取代的手性中心.
1 结果与讨论
1.1 反应条件优化
首先, 我们以2, 2, 2-三氟甲基苯乙酮 (1a) (1 equiv.)、硝基甲烷 (2a) (10 equiv.) 作为模板反应, 采用不同的手性硫脲3 (0.1 equiv.) 作为有机催化剂, 对反应条件进行了探索 (表 1).通过研究我们发现, 这些由 (+)-奎宁或 (+)-辛可宁衍生的手性催化剂[11]绝大多数都可以催化此Henry反应, 并能以中等ee值得到目标产物 (表 1, Entries 1~7).其中, 手性催化剂3b和3d可以得到更好的收率和ee值 (表 1, Entries 2, 4).于是, 我们选用3b和3d作为催化剂, 又对溶剂进行了筛选 (表 1, Entries 8~19).我们首先对常见的溶剂进行了筛选, 发现无论是极性溶剂或是非极性溶剂, 甲苯条件下得到的结果最好 (表 1, Entries 2, 4).值得一提的是, 在筛选溶剂时我们也尝试了直接采用硝基甲烷作为溶剂 (表 1, Entries 18, 19).发现尽管在此条件下4a的产率有所提高, 然而其ee值却降低 (表 1, Entries 2和4 vs Entries 18和19).我们认为导致这一结果的可能原因是硝基甲烷作为溶剂提高了反应物的浓度, 加快了反应的速率, 降低了反应的对映选择性.
 表 1
硫脲催化剂与溶剂的筛选a
Table 1.
Screening of thiourea catalysts and solvents for asymmetric Henry reaction
表 1
硫脲催化剂与溶剂的筛选a
Table 1.
Screening of thiourea catalysts and solvents for asymmetric Henry reaction

Entry Catalyst Solvent Yield b/% of 4a eec/% of 4a 1 3a Toluene 67 66 2 3b Toluene 78 76 3 3c Toluene 56 69 4 3d Toluene 80 71 5 3e Toluene 47 57 6 3f Toluene 44 53 7 3g Toluene 38 55 8 3b DCM 37 49 9 3d DCM 66 68 10 3b CHCl3 12 36 11 3d CHCl3 10 45 12 3b THF n.d. 13 3d THF n.d. 14 3b Et2O 53 27 15 3d Et2O 57 32 16 3b MeOH n.d. 17 3d MeOH n.d. 18 3b CH3NO2 82 59 19 3d CH3NO2 86 57 aAll reactions were carried out by using 0.25 mmol of 1a, 10 equiv. of CH3NO2, 0.1 equiv.. of 3, 3 mL of solvent; bIsolated yield after flash chromatography; c Determined by HPLC with chiral column. n.d.=no detection. 表 1 硫脲催化剂与溶剂的筛选a
Table 1. Screening of thiourea catalysts and solvents for asymmetric Henry reaction基于上述初步条件筛选, 又在3b和3d催化作用下, 对温度和反应的物料比进行了筛选 (表 2).首先, 我们对温度进行了筛选.发现在室温和0 ℃下, 目标产物的产率和ee值相较于之前条件有所下降 (表 2, Entries 1~4).幸运的是, 当温度降至-40 ℃时, 催化剂3b可很好地催化该反应, 并以83%的ee值得到目标产物4a(表 2, Entry 5).继续降低反应温度至-60 ℃, 该反应ee值下降至59%(表 2, Entry 7).比较催化剂3b和3d在该反应中获得的初步结果, 我们随后选择了催化剂3b对其在该反应中的用量进行了筛选 (表 2, Entries 9~11).经研究发现, 当催化剂3b的用量为10 mol%时, 所得结果最优 (表 2, Entry 5 vs Entries 9和10).
 表 2
在催化剂3b和3d作用下对温度和物料比的筛选a
Table 2.
Screening of temperature and molar ratio with catalysts 3b and 3d
表 2
在催化剂3b和3d作用下对温度和物料比的筛选a
Table 2.
Screening of temperature and molar ratio with catalysts 3b and 3d

Entry Catalyst Temp/℃ Yield b/% of 4a eec/% of 4a 1 3b r.t. 72 9 2 3d r.t. 70 10 3 3b 0 73 34 4 3d 0 68 38 5 3b -40 84 83 6 3d -40 88 78 7 3b -60 10 59 8 3d -60 10 55 9 d 3b -40 87 63 10 e 3b -40 88 71 11 f 3b -40 87 72 aAll reactions were carried out by using 0.25 mmol of 1a, 10 equiv. of CH3NO2, 0.1 equiv. of 3, 3 mL of solvent; bIsolated yield after flash chromatography; cDetermined by HPLC with chiral column; d0.05 equiv. of catalyst 3b was used; e0.15 equiv. of catalyst 3b was used; f0.2 equiv. of catalyst 3b was used. 表 2 在催化剂3b和3d作用下对温度和物料比的筛选a
Table 2. Screening of temperature and molar ratio with catalysts 3b and 3d综上所述, 我们最终确定该不对称Henry反应的最佳条件为:催化剂为3b, 2, 2, 2-三氟甲基苯乙酮 (1a)、硝基甲烷 (2a) 和催化剂3b之间的物料比为1:10:0.1, 溶剂为甲苯, 反应温度为-40 ℃.
1.2 反应底物拓展
在上述最佳反应条件下, 对反应的底物进行了拓展, 实验结果见表 3.研究结果表明, 苯环上含不同取代基的2, 2, 2-三氟甲基苯乙酮与硝基甲烷反应均能以良好的产率 (表 3, 44%~84%) 和较高的ee值 (表 3, 73~84% ee) 得到相应的目标产物.当苯环上含有供电子的甲基和甲氧基时, 产物的ee值略有下降 (表 3, 4b和4c).苯环上吸电子取代的位置对反应的产率有些许影响, 但是对ee值影响较小 (表 3, 4d~4l).同样, 3, 5-二氯取代的底物1m也可以63%的产率, 84%的ee值转化为相应的产物4m.肉桂基取代的2, 2, 2-三氟甲基苯乙酮 (1n) 在该标准反应条件下却不能发生所期望的反应.我们只回收到了原料.
 表 3
2, 2, 2-三氟甲基苯乙酮不对称Henry反应底物拓展a
Table 3.
Scope of enantioselective Henry reaction of trifluoromethyl ketones
表 3
2, 2, 2-三氟甲基苯乙酮不对称Henry反应底物拓展a
Table 3.
Scope of enantioselective Henry reaction of trifluoromethyl ketones
 表 3 2, 2, 2-三氟甲基苯乙酮不对称Henry反应底物拓展a
表 3 2, 2, 2-三氟甲基苯乙酮不对称Henry反应底物拓展a
Table 3. Scope of enantioselective Henry reaction of trifluoromethyl ketones2 结论
综上所述, 本文报道了奎宁衍生化的简易双官能团硫脲催化的不对称Henry反应.该方法以2, 2, 2-三氟甲基苯乙酮作为三氟甲基合成砌块, 成功地构筑了含CF3的手性中心, 并得到了理想的产率和较好的ee值.该方法为2, 2, 2-三氟甲基苯乙酮的不对称Henry反应提供了有效的补充.我们课题小组对三氟甲基合成砌块参与的不对称催化三氟甲基化反应正在进行进一步探索.
3 实验部分
3.1 仪器与试剂
红外光谱仪为Digilab FTS 3000, 固体采用KBr压片法, 液体采用液膜法; 核磁共振谱用Varian Mercury 400 plus或Agilent DD2 600型核磁共振仪测定, 以氘代氯仿作为溶剂, TMS为内标; 高分辨质谱用Thermo LTQ-Orbitrap Elite-ETD测定, ESI源; 质谱用Thermo Trace DSQ气相色谱质谱联用仪测定, EI源; 化合物的ee值是根据北京温分分析仪器LC98I测定; 熔点测定用显微熔点测定仪测定, 温度未校正.
实验中所用手性催化剂是根据文献[11]自制; 起始原料除1a是商业获得外, 其余原料1b~1n是根据文献[12]自制; 所用试剂均为国产分析纯级试剂.
3.2 实验方法
在10 mL圆底烧瓶中, 加入手性催化剂3b (0.025 mmol, 15 mg, 0.1 equiv.).将其溶于2 mL甲苯后, 整个反应体系冷却至-40 ℃.然后在搅拌条件下, 将硝基甲烷2a (2.5 mmol, 136 μL, 10 equiv.) 加入至反应体系中, 并搅拌10 min.随之向体系中加入2, 2, 2-三氟甲基苯乙酮1a (0.25 mmol, 44 mg).加毕, 将反应体系置于-40 ℃, 继续搅拌反应90 h. TLC检测反应完全后, 向体系中加入三氟乙酸 (10 μL, 0.1 equiv.) 淬灭反应.将体系置于旋转蒸发仪上, 减压除去溶剂后, 残留物用柱层析进行洗脱分离[V(石油醚):V(乙酸乙酯)=10:1], 进而得到所需产物4a.
3.3 化合物的光谱数据
1, 1, 1-三氟-3-硝基-2-苯基-2-丙醇 (4a)[13]:淡黄色液体; 得产物50 mg; 产率84%. 1H NMR (CDCl3, 400 MHz) δ: 7.58~7.60 (m, 2H), 7.44~7.46 (m, 3H), 5.10 (d, J=13.6 Hz, 1H), 5.01 (d, J=13.6 Hz, 1H), 4.63 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 133.0, 130.0, 129.0, 126.1, 123.4 (q, JC-F=284.0 Hz), 77.5, 76.2 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-79.1; IR (neat) ν: 3529, 2925, 1717, 1561, 1185, 707 cm-1; HRMS (ESI) calcd for C9H8F3NO3Na[M+Na]+ 258.0348, found 258.0349; HPLC ee: 83% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=42.56 min, minor isomer: tR=32.80 min].
1, 1, 1-三氟-3-硝基-2-(4-甲基苯基)-2-丙醇 (4b)[13]:淡黄色液体, 得产物41 mg, 产率66%. 1H NMR (CDCl3, 400 MHz) δ: 7.46 (d, J=8.0 Hz, 2H), 7.24 (d, J=8.0 Hz, 2H), 5.07 (d, J=13.6 Hz, 1H), 4.98 (d, J=13.6 Hz, 1H), 4.55 (s, 1H), 2.37 (s, 3H); 13C NMR (CDCl3, 100 MHz) δ: 140.1, 130.0, 129.7, 126.0, 123.4 (q, JC-F=284.0 Hz), 77.5, 76.2 (q, JC-F=30.0 Hz), 21.1; 19F NMR (CDCl3, 376 MHz) δ:-79.3; IR (neat) ν: 3519, 2935, 1571, 1384, 1165, 821, 675 cm-1; GC-MS (EI 70 eV) m/z (%): 249 (27, [M+]), 203 (14, [M-NO2]+), 189 (8, [M-CH2NO2]+), 180 (16, [M-CF3]+), 158 (24, [M-C7H7]+), 134 (8, [M-CF3-NO2]+), 119 (100, [M-C2H3F3NO2]), 91 (45, [M-C3H3F3NO3]); HPLC ee: 80% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=43.24 min, minor isomer: tR=32.63 min].
1, 1, 1-三氟-3-硝基-2-(4-甲氧基苯基)-2-丙醇 (4c)[13]:淡黄色液体, 得产物44 mg, 产率67%. 1H NMR (CDCl3, 400 MHz) δ: 7.49 (d, J=8.8 Hz, 2H), 6.95~6.93 (m, 2H), 5.06 (d, J=13.6 Hz, 1H), 4.96 (d, J=13.6 Hz, 1H), 4.57 (s, 1H), 3.80 (s, 3H); 13C NMR (CDCl3, 100 MHz) δ: 160.7, 127.5, 123.5 (q, JC-F=284.0 Hz), 124.7, 114.3, 77.5, 76.0 (q, JC-F=30.0 Hz), 55.3; 19F NMR (CDCl3, 376 MHz) δ:-79.5; IR (neat) ν: 3518, 3029, 2915, 2831, 1707, 1561, 1175, 1030, 842, 769, 675 cm-1; HRMS (ESI) calcd for C10H10F3NO4Na[M+Na]+ 288.0454, found 288.0453; HPLC ee: 76% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=57.32 min, minor isomer: tR=50.64 min].
1, 1, 1-三氟-3-硝基-2-(4-氟苯基)-2-丙醇 (4d)[13]:淡黄色液体, 得产物36 mg, 产率57%. 1H NMR (CDCl3, 600 MHz) δ: 7.59 (dd, J=9.0, 5.4 Hz, 2H), 7.14 (t, J=8.4 Hz, 2H), 5.07 (d, J=13.2 Hz, 1H), 5.00 (d, J=13.8 Hz, 1H), 4.65 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 163.6 (d, JC-F=249.0 Hz), 128.7 (d, JC-F=30.0 Hz), 128.3 (d, JC-F=9.0 Hz), 123.3 (q, JC-F=284.0 Hz), 116.1 (d, JC-F=22.0 Hz), 77.4, 76.0 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-79.3, -111.4; IR (neat) ν: 3512, 2913, 1730, 1561, 1372, 1185, 1091, 1019, 821, 675 cm-1; GC-MS (EI 70 eV) m/z (%): 253 (13, [M+]), 207 (8, [M-NO2]+), 193 (7, [M-CH2NO2]+), 184 (18, [M-CF3]+), 141 (16, [M-C3H3F3O]+), 138 (7, [M-CF3NO2]+), 123 (100, [M-C2H3F3NO2]+), 95 (31, [M-C3H3F3NO3]+); HPLC ee: 81% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=95/5, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=46.22 min, minor isomer: tR=42.78 min].
1, 1, 1-三氟-3-硝基-2-(4-氯苯基)-2-丙醇 (4e)[13]:淡黄色液体, 得产物56 mg, 产率83%. 1H NMR (CDCl3, 600 MHz) δ: 7.53 (d, J=8.4 Hz, 2H), 7.43 (d, J=8.4 Hz, 2H), 5.06 (d, J=13.8 Hz, 1H), 5.00 (d, J=13.8 Hz, 1H), 4.63 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 136.4, 131.4, 129.3, 127.7, 123.2 (q, JC-F=284.0 Hz), 77.3, 76.0 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-79.2; IR (neat) ν: 3512, 2913, 1730, 1561, 1372, 1185, 1091, 1019, 821, 675 cm-1; GC-MS (EI 70 eV) m/z (%): 269 (25) [M+], 223 (10, [M-NO2]+), 209 (7, [M-CH2-NO2]+), 200 (17, [M-CF3]+), 157 (17, [M-C3H3F3O]+), 154 (6, [M-CF3NO2]+), 139 (100, [M-C2H3F3NO2]+), 111 (24, [M-C3H3F3NO3]+); HPLC ee: 83% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=38.55 min, minor isomer: tR=31.78 min].
1, 1, 1-三氟-3-硝基-2-(2-氯苯基)-2-丙醇 (4f):淡黄色液体, 得产物45 mg, 产率67%. 1H NMR (CDCl3, 600 MHz) δ: 7.94 (dd, J=1.8, 7.8 Hz, 1H), 7.43 (dd, J=1.8, 7.8 Hz, 1H), 7.40~7.35 (m, 2H), 5.99 (d, J=14.4 Hz, 1H), 5.09 (d, J=14.4 Hz, 1H), 4.73 (s, 1H); 13C NMR (CDCl3, 150 MHz) δ: 132.2, 131.7, 131.4, 130.8, 130.7, 127.5, 123.4 (q, JC-F=285.0 Hz), 77.2, 76.7 (q, JC-F=32.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-77.6; IR (neat) ν: 3514, 3064, 2182, 1560, 1176, 1107, 1029, 915, 759, 720 cm-1; HRMS (ESI) calcd for C9H8F3NO3Na[M+Na]+ 291.9952, found 291.9959; HPLC ee: 83% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=95/5, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=28.83 min, minor isomer: tR=35.70 min].
1, 1, 1-三氟-3-硝基-2-(3-氯苯基)-2-丙醇 (4g):淡黄色液体, 得产物34 mg, 产率50%. 1H NMR (CDCl3, 600 MHz) δ: 7.64 (s, 1H), 7.45~7.43 (m, 2H), 7.40~7.39 (m, 1H), 5.05 (d, J=13.8 Hz, 1H), 5.00 (d, J=13.8 Hz, 1H), 4.68(s, 1H); 13C NMR (CDCl3, 150 MHz) δ: 135.3, 135.0, 130.3, 130.2, 126.7, 124.2, 123.2 (q, JC-F=284.0 Hz), 77.2, 75.8 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-79.0; IR (neat) ν: 3519, 2915, 1571, 1436, 1372, 1185, 790, 707 cm-1; GC-MS (EI 70 eV) m/z (%): 269 (47, [M+]), 223 (9, [M-NO2]+), 209 (5, [M-CH2NO2]+), 200 (16, [M-CF3]+), 157 (27, [M-C3H3F3O]+), 154 (5, [M-CF3NO2]+), 139 (100, [M-C2H3F3NO2]+), 111 (29, [M-C3H3F3NO3]+); HPLC ee: 84% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=45.71 min, minor isomer: tR=26.63 min].
1, 1, 1-三氟-3-硝基-2-(4-溴苯基)-2-丙醇 (4h)[7]:淡黄色液体, 得产物49 mg, 产率63%. 1H NMR (CDCl3, 600 MHz) δ: 7.58 (d, J=9.0 Hz, 2H), 7.46 (d, J=8.4 Hz, 2H), 5.05 (d, J=13.8 Hz, 1H), 4.99 (d, J=13.8 Hz, 1H), 4.63 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 132.2, 132.0, 127.9, 124.7, 123.1 (q, JC-F=284.0 Hz), 77.2, 76.0 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-79.2; IR (neat) ν: 3519, 2925, 1561, 1384, 1165, 998, 821, 675 cm-1; GC-MS (EI 70 eV) m/z (%): 313 (54, [M+]), 267 (13, [M-NO2]+), 253 (8, [M-CH2NO2]+), 244 (20, [M-CF3]+), 201 (21, [M-C3H3F3O]+), 188 (51, [M-Br-NO2]+), 183 (100, [M-C2H2F3NO2]+), 158 (5, [M-C6H4Br]+), 155 (24, [M-C3H3F3NO3]+); HPLC ee: 81% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=43.73 min, minor isomer: tR=33.33 min].
1, 1, 1-三氟-3-硝基-2-(3-溴苯基)-2-丙醇 (4i):淡黄色液体, 得产物34 mg, 产率44%. 1H NMR (CDCl3, 400 MHz) δ: 7.79 (s, 1H), 7.59 (d, J=8.0 Hz, 1H), 7.49 (d, J=8.0 Hz, 1H), 7.32 (t, J=7.6 Hz, 1H), 4.68 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 135.1, 133.3, 130.4, 129.6, 124.7, 123.3, 123.2 (q, JC-F=284.0 Hz), 77.2, 75.5 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-78.9; IR (neat) ν: 3519, 2915, 1561, 1384, 1175, 695 cm-1; GC-MS (EI 70 eV) m/z (%): 313 (55, [M+]), 267 (14, [M-NO2]+), 253 (6, [M-CH2NO2]+), 244 (21, [M-CF3]+), 201 (32, [M-C3H3F3O]+), 188 (63, [M-BrNO2]+), 183 (100, [M-C2H3F3NO2]+), 158 (9, [M-C6H4Br]+), 155 (29, [M-C3H3F3NO3]+); HPLC ee: 80% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=52.86 min, minor isomer: tR=29.09 min].
1, 1, 1-三氟-3-硝基-2-(4-三氟甲基苯基)-2-丙醇 (4j)[13]:淡黄色液体, 得产物48 mg, 产率64%. 1H NMR (CDCl3, 600 MHz) δ: 7.72~7.76 (m, 4H), 5.10 (d, J=13.8 Hz, 1H), 5.04 (d, J=13.8 Hz, 1H), 4.73 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 136.8, 132.3 (q, JC-F=32.0 Hz), 126.8, 126.0 (q, JC-F=4.0 Hz), 123.5 (q, JC-F=271.0 Hz), 123.1 (q, JC-F=284.0 Hz), 77.2, 76.1 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-79.0, -63.5; IR (neat) ν: 3512, 2940, 1703, 1566, 1322, 1171, 845, 682 cm-1; GC-MS (EI 70 eV) m/z (%): 303 (6, [M+]), 257 (7, [M-NO2]+), 243 (4, [M-CH2NO2]+), 234 (27, [M-CF3]+), 191 (29, [M-C3H3F3O]+), 188 (5, [M-CF3-NO2]+), 173 (100, [M-C2H3F3NO2]+), 145 (53, [M-C3H3F3NO3]+); HPLC ee: 81% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=27.69 min, minor isomer: tR=23.64 min].
1, 1, 1-三氟-3-硝基-2-(4-硝基苯基)-2-丙醇 (4k):淡黄色固体, 得产物50 mg, 产率71%. m.p. 89~91 ℃; 1H NMR (CDCl3, 600 MHz) δ: 8.32~8.31 (m, 2H), 7.84 (d, J=9.0 Hz, 2H), 5.16 (d, J=13.8 Hz, 1H), 5.10 (d, J=13.8 Hz, 1H), 4.84 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 148.4, 139.7, 127.7, 124.0, 123.0 (q, JC-F=190.0 Hz), 77.2, 76.1 (q, JC-F=20.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-78.8; IR (neat) ν: 3418, 3046, 1602, 1557, 1434, 1362, 1296, 1260, 1179, 1107, 1035, 846 cm-1; HRMS (ESI) calcd for C9H7F3N2O5H[M+H]+ 281.0380, found 281.0374; HPLC ee: 81% [Chiralpak OJ-H, V(n-hexane)/ V(i-PrOH)=90/10, 30 ℃, 1.0 mL/min, 215 nm, major isomer:tR=22.76 min, minor isomer: tR=20.68 min].
1, 1, 1-三氟-3-硝基-2-(3-硝基苯基)-2-丙醇 (4l):淡黄色液体, 得产物42 mg, 产率60%. 1H NMR (CDCl3, 400 MHz) δ: 8.53 (s, 1H), 8.35~8.32 (m, 1H), 7.96~7.93 (m, 1H), 7.62~7.67 (m, 1H), 5.16~5.07 (m, 2H), 4.89 (s, 1H); 13C NMR (CDCl3, 100 MHz) δ: 148.6, 135.2, 132.1, 130.2, 125.1, 123.0 (q, JC-F=189.0 Hz), 121.8, 77.1, 75.8 (q, JC-F=20.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-78.9; IR (neat) ν: 3472, 2926, 1560, 1428, 1353, 1173, 807, 687 cm-1; GC-MS (EI 70 eV) m/z (%): 280 (3, [M+]), 234 (28, [M-NO2]+), 220 (4, [M-CH2NO2]+), 211 (50, [M-CF3]+), 168 (47, [M-C3H3F3O]+), 165 (3, [M-CF3-NO2]+), 150 (100, [M-C2H3F3NO2]+), 122 (2, [M-C3H3F3NO3]+); HPLC ee: 73% [Chiralpak OJ-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 1.0 mL/min, 215 nm, major isomer: tR=40.47 min, minor isomer: tR=32.62 min].
1, 1, 1-三氟-3-硝基-2-(3, 5-二氯苯基)-2-丙醇 (4m)[14]:淡黄色液体, 得产物48 mg, 产率63%. 1H NMR (CDCl3, 400 MHz) δ: 7.49 (s, 2H), 7.46~7.45 (m, 1H), 5.01 (s, 2H), 4.78 (s, 1H); 13C NMR (CDCl3, 150 MHz) δ: 136.3, 136.0, 130.4, 125.0, 122.9 (q, JC-F=284.0 Hz), 77.0, 75.6 (q, JC-F=30.0 Hz); 19F NMR (CDCl3, 376 MHz) δ:-78.8; IR (neat) ν: 3452, 2924, 2196, 1560, 1376, 1174, 862, 802, 604 cm-1; GC-MS (EI 70 eV) m/z (%): 303 (54, [M+]), 257 (7, [M-NO2]+), 243 (5, [M-CH2NO2]+), 234 (10, [M-CF3]+), 191 (33, [M-C3H3F3O]+), 187 (4, [M-Cl2NO2]+), 173 (100, [M-C2H3F3NO2]+), 158 (5, [M-C6HCl2]+), 145 (38, [M-C3H3F3NO3]+); HPLC ee: 84% [Chiralpak OD-H, V(n-hexane)/V(i-PrOH)=90/10, 30 ℃, 0.5 mL/min, 210 nm, major isomer: tR=24.10 min, minor isomer: tR=20.67 min]
辅助材料 (Supporting Information)合成产物的核磁共振氢谱、碳谱、氟谱和高分辨质谱以及高效液相色谱.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
(a) O'Hagan, D. Chem. Soc. Rev. 2008, 37, 308.
(b) Ni, C. F.; Zhu, L. G.; Hu, J. B. Acta Chim. Sinica 2015, 73, 90 (in Chinese).
(倪传法, 朱林桂, 胡金波, 化学学报, 2015, 73, 90.)
(c) Xu, J. B.; Chen, P. H.; Ye, J. X.; Liu, G. S. Acta Chim. Sinica 2015, 73, 1294 (in Chinese).
(徐佳斌, 陈品红, 叶金星, 刘国生, 化学学报, 2015, 73, 1294.) -
[2]
(a) Kirsch, P. Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications 2nd ed., Wiley-VCH, Weinheim, Germany, 2013, pp. 299~301.
(b) Müller, K.; Faeh, C.; Diederich, F. Science 2007, 317, 1881.
(c) Bégué, J.-P.; Bonnet-Delpon, D. Bioorganic and Medicinal Chemistry of Fluorine, John Wiley & Sons Inc., Hoboken, New Jersey 2008, pp. 1~351.
(d) Hagmann, W. J. Med. Chem. 2008, 51, 4359.
(e) Filler, R.; Saha, R. Future Med. Chem. 2009, 1, 777.
(f) Ojima, I. Fluorine in Medicinal Chemistry and Chemical Biology, Wiley, Chichester, U. K., 2009, pp. 1~523.
(g) Lin, G.-Q.; You, Q.-D.; Cheng, J.-F. Chiral Drugs: Chemistry and Biological Action, Wiley, Hoboken, New Jersey, 2011.
(h) Purser, S.; Moore, P.; Swallow, S.; Gouverneur, V. Chem. Soc. Rev. 2008, 37, 320.
(i) Schäcke, H.; Schottelius, A.; Döcke, W.-D.; Strehlke, P.; Jaroch, S.; Schmees, N.; Rehwinkel, H.; Hennekes, H.; Asadullah, K. Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 227.
(j) Gauthier, J.; Chauret, N.; Cromlish, W.; Desmarais, S.; Duong, L.; Falgueyret, J.-P.; Kimmel, D.; Lamontagne, S.; Léger, S.; LeRiche, T.; Li, C.; Massé, F.; McKay, D.; Nicoll-Griffith, D.; Oballa, R.; Palmer, J.; Percival, M.; Riendeau, D.; Robichaud, J.; Rodan, G.; Rodan, S.; Seto, C.; Thérien, M.; Truong, V.-L.; Venuti, M.; Wesolowski, G.; Young, R.; Zamboni, R.; Black, W. Bioorg. Med. Chem. Lett. 2008, 18, 923.
(k) O'Shea, P.; Chen, C.-Y.; Gauvreau, D.; Gosselin, F.; Hughes, G.; Nadeau, C.; Volante, R. J. Org. Chem. 2009, 74, 1605.
(l) Ojima, I.; Slater, J. Chirality 1997, 9, 487.
(m) Pierce, M.; Parsons, R.; Radesca, L.; Lo, Y.; Silverman, S.; Moore, J.; Islam, Q.; Choudhury, A.; Fortunak, J.; Nguyen, D.; Luo, C.; Morgan, S.; Davis, W.; Confalone, P.; Chen, C.-Y.; Tillyer, R.; Frey, L.; Tan, L.; Xu, F.; Zhao, D.; Thompson, A.; Corley, E.; Grabowski, E.; Reamer, R.; Reider, P. J. Org. Chem. 1998, 63, 8536.
(n) Corbett, J.; Ko, S.; Rodgers, J.; Gearhart, L.; Magnus, N.; Bacheler, L.; Diamond, S.; Jeffrey, S.; Klabe, R.; Cordova, B.; Garber, S.; Logue, K.; Trainor, G.; Anderson, P.; Erickson-Viitanen, S. J. Med. Chem. 2000, 43, 2019.
(o) Zhang, K.; Xu, X. H.; Qing, F. L. Chin. J. Org. Chem. 2015, 35, 556 (in Chinese).
(张柯, 徐修华, 卿凤翎, 有机化学, 2015, 35, 556.)
(p) Ni, Y.; Xu, T. M.; Zhong, L. K.; Kong, X. Y.; Shi, J.-J.; Liu, X. H.; Kong, X. L.; Ji, W. J.; Tan, C. X. Chin. J. Org. Chem. 2015, 35, 2218 (in Chinese).
(倪芸, 许天明, 钟良坤, 孔晓燕, 史建俊, 刘幸海, 孔小林, 姬文娟, 谭成侠, 有机化学, 2015, 35, 2218.)
(q) Dai, H.; Li, H.; Jin, Z. C.; Liu, W. Y.; Xiao, Y.; He, H. B.; Wang, Q. M.; Shi, Y. J. Chin. J. Org. Chem. 2016, 36, 185 (in Chinese).
(戴红, 李宏, 金智超, 刘文永, 肖瑶, 何海兵, 汪清民, 石玉军, 有机化学, 2016, 36, 185.) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345263.shtml -
[3]
(a) Shibata, N.; Mizuta, S.; Kawai, H. Tetrahedron: Asymmetry 2008, 19, 2633.
(b) Ma, J.-A.; Cahard, D. Chem. Rev. 2008, 108, PR1.
(c) Zheng, Y.; Ma, J.-A. Adv. Synth. Catal. 2010, 352, 2745.
(d) Valero, G.; Companyó, X.; Rios, R. Chem.-Eur. J. 2011, 17, 2018.
(e) Genoni, A.; Benaglia, M.; Massolo, E.; Rossi, S. Chem. Commun. 2013, 49, 8365. -
[4]
Nie, J.; Guo, H.-C.; Cahard, D.; Ma, J.-A. Chem. Rev. 2011, 111, 455. doi: 10.1021/cr100166a
-
[5]
(a) Boruwa, J.; Gogoi, N.; Saikia, P. P.; Barua, N. C. Tetrahedron: Asymmetry 2006, 17, 3315.
(b) Marcelli, T.; van der Haas, R.; van Maarseveen, J.; Hiemstra, H. Angew. Chem., Int. Ed. 2006, 45, 929.
(c) Hammar, P.; Marcelli, T.; Hiemstra, H.; Himo, F. Adv. Synth. Catal. 2007, 349, 2537. -
[6]
(a) Misumi, Y.; Bulman, R. A.; Matsumoto, K. Heterocycles 2002, 56, 599.
(b) Tur, F.; Saá, J. Org. Lett. 2007, 9, 5079.
(c) Saá, J. M.; Tur, F.; González, J. Chirality 2009, 21, 836.
(d) Tur, F.; Mansilla, J.; Lillo, V. J.; Saá, J. M. Synthesis 2010, 1909.
(e) Vlatkovic, M.; Bernardi, L.; Otten, E.; Feringa, B. L. Chem. Commun. 2014, 50, 7773.
(f) Das, A.; Choudhary, M. K.; Kureshy, R. I.; Jana, K.; Verma, S.; Khan, N. H.; Abdi, S. H. R.; Bajaj, H. C.; Ganguly, B., Tetrahedron 2015, 71, 5229. -
[7]
Bandini, M.; Sinisi, R.; Umani-Ronchi, A. Chem. Commun. 2008, 4360.
-
[8]
Palacio, C.; Connon, S. J. Org. Lett. 2011, 13, 1298. doi: 10.1021/ol103089j
-
[9]
(a) Doyle, A.; Jacobsen, E. Chem. Rev. 2007, 107, 5713.
(b) Connon, S. Chem. Commun. 2008, 2499.
(c) Hideto, M.; Yoshiji, T. Chem. Soc. Jpn. 2008, 81, 785.
(d) Yu, X.; Wang, W. Chem.-Asian J. 2008, 3, 516.
(e) Schreiner, P. Chem. Soc. Rev. 2003, 32, 289. -
[10]
(a) Xu, J.; Hu, Y.; Huang, D.; Wang, K.-H.; Xu, C.; Niu, T. Adv. Synth. Catal. 2012, 354, 515.
(b) Ji, S.; Alkhalil, A.; Su, Y.; Xia, X.; Chong, S.; Wang, K.-H.; Huang, D.; Fu, Y.; Hu, Y. Synlett 2015, 26, 1725. -
[11]
(a) Vakulya, B.; Varga, S.; Csámpai, A.; Soós, T. Org. Lett. 2005, 7, 1967.
(b) Bassas, O.; Huuskonen, J.; Rissanen, K.; Koskinen, A. M. P. Eur. J. Org. Chem. 2009, 1340. -
[12]
(a) Rudzinski, D.; Kelly, C.; Leadbeater, N. Chem. Commun. 2012, 48, 9610.
(b) Wiedemann, J.; Heiner, T.; Mloston, G.; Prakash, G.; Olah, G. Angew. Chem., Int. Ed. 1998, 37, 820. -
[13]
Liu, W.; Lai, X.; Zha, G.; Xu, Y.; Sun, P.; Xia, T.; Shen, Y. Org. Biomol. Chem. 2016, 14, 3603. doi: 10.1039/C6OB00119J
-
[14]
Lu, L.; Jerome, C. WO 2014114250, 2014[Chem. Abstr. 2014, 161, 290900].
-
[1]
-
表 1 硫脲催化剂与溶剂的筛选a
Table 1. Screening of thiourea catalysts and solvents for asymmetric Henry reaction

Entry Catalyst Solvent Yield b/% of 4a eec/% of 4a 1 3a Toluene 67 66 2 3b Toluene 78 76 3 3c Toluene 56 69 4 3d Toluene 80 71 5 3e Toluene 47 57 6 3f Toluene 44 53 7 3g Toluene 38 55 8 3b DCM 37 49 9 3d DCM 66 68 10 3b CHCl3 12 36 11 3d CHCl3 10 45 12 3b THF n.d. 13 3d THF n.d. 14 3b Et2O 53 27 15 3d Et2O 57 32 16 3b MeOH n.d. 17 3d MeOH n.d. 18 3b CH3NO2 82 59 19 3d CH3NO2 86 57 aAll reactions were carried out by using 0.25 mmol of 1a, 10 equiv. of CH3NO2, 0.1 equiv.. of 3, 3 mL of solvent; bIsolated yield after flash chromatography; c Determined by HPLC with chiral column. n.d.=no detection. 表 2 在催化剂3b和3d作用下对温度和物料比的筛选a
Table 2. Screening of temperature and molar ratio with catalysts 3b and 3d

Entry Catalyst Temp/℃ Yield b/% of 4a eec/% of 4a 1 3b r.t. 72 9 2 3d r.t. 70 10 3 3b 0 73 34 4 3d 0 68 38 5 3b -40 84 83 6 3d -40 88 78 7 3b -60 10 59 8 3d -60 10 55 9 d 3b -40 87 63 10 e 3b -40 88 71 11 f 3b -40 87 72 aAll reactions were carried out by using 0.25 mmol of 1a, 10 equiv. of CH3NO2, 0.1 equiv. of 3, 3 mL of solvent; bIsolated yield after flash chromatography; cDetermined by HPLC with chiral column; d0.05 equiv. of catalyst 3b was used; e0.15 equiv. of catalyst 3b was used; f0.2 equiv. of catalyst 3b was used. 表 3 2, 2, 2-三氟甲基苯乙酮不对称Henry反应底物拓展a
Table 3. Scope of enantioselective Henry reaction of trifluoromethyl ketones

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1012
- HTML全文浏览量: 134


 下载:
下载:
 下载:
下载:

